Перфосфат
Cтраница 2
Дальнейшие исследования Фихтера и Рюис-и - Мирок31 зали, - что для получения хорошего выхода перфосфата при тролизе концентрированных растворов необходимо, чтобы отнс шение мекду щелочью и фосфорной кислотой соответственно нялось бы ПО крайней мере 2 эквивалентам на 1 молекулу, держание мононадфосфорной кислоты возрастает с увеличение плотности тока, с уменьшением общей концентрации и с J нием щелочности. В процессе электролиза выход по току If падает. Далее, измерения потенциала электрода под током пока - Я зали, что добавка фтористого калия повышает потенциал лишь при л плотностях тока выше 0 05 а / ел8, тогда как при Практически при у меняемfcjx плотностях тока отлЩ2 до 0 03 а / см2 рна. [16]
НЗОГ, откуда следует, что отношение долей Оа из персульфата и из воды равно &2 Ш ] / & г. С нашими данными для перфосфата отношение &2 / &i изменяется в изученном интервале рН на два порядка, вместо того чтобы оставаться постоянным. [17]
Перекись бензоила является подходящим катализатором для эмульсионной полимеризации, но ее можно заменить другими неорганическими перекисями, как, например, перекисью водорода, перборатом или перфосфатом натрия. В патентной литературе имеются указания, что для регулирования таких реакций часто добавляются следы других веществ как органических, так и неорганических. [18]
В книге рассмотрены последние достижения в области изучения механизма процессов и условий проведения реакций электрохимического синтеза неорганических окислителей и восстановителей ( соединений галогенов, надсерной кислоты, персульфатов, перборатов и перфосфатов, кислородных соединений металлов, гидроксиламина и дитионита натрия); описаны промышленные электролизеры для их синтеза. [19]
С помощью кислорода 180 систематически изучались разнообразные реакции образования, разложения и другие превращения различных перекисных соединений, В частности, был исследован механизм анодного образования, гидролиза и термического разложения персульфата, перкарбоната, пербората, перфосфата, механизм реакций, лежащих в основе главных промышленных методов получения перекиси водорода, детально изучены процессы, протекающие при электролизе сульфатов. Было, например, установлено, что при окислении кислородом этилантрагидрохи-нона и изопропилового спирта кислород образующийся перекиси водорода происходит из готовой фазы. При электролизе серной кислоты и бисульфата перекись водорода не является, как это предполагалось ранее, продуктом анодного окисления, а получается при вторичных реакциях гидролиза образовавшегося персульфата. [20]
Растворителем вмЪстб1 йоды служит насыщенный раствор нитрата аммония. Перфосфат серебра получается в виде светлого серовато-коричневатого. Через короткое время он полностью разлагается. [21]
Его получают, растворяя на холоду одни моль пирофосфата натрия в трех молях концентрированной перекиси водорода. Образующийся раствор перфосфата натрия затем подвергают выпариванию под вакуумом. Перфосфат натрия является очень мягким окислителем, но он менее стоек, чем другие персоли. [22]
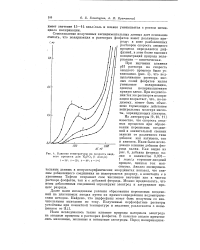 |
Влияние температуры на скорость анодного процесса для К3Р04 ( 1 моль / л г - 35. 3 - 25. 3 - 18. 4 - 5 С. [23] |
Далее нами исследованы условия образования перекисных соединений на платиновых анодах путем их прямого определения иодометриче-ским методом. Найдено, что перфосфаты могут быть получены со значительными выходами по току. [24]
Перф осфаты образуются При электролизе КаНРО, NH) HHPO ( и RbaHPO, CsaHPO, но тш не образуются лри электролизе фосфорной слоты и фосфатов лития, натрия и таллия. При действии переписи водорода на большинство фосфатов щелочных и щелочноземельных металлов выделяются Hie перфосфаты, а определенные Кристаллические пер гидраты фосфатов, которым посвящен специальный раздел ( стр. [25]
Многие перекиси и соли надкислот являются производными перекиси водорода. Некоторые из них малорастворимы, например перекись бария ВаО2, другие легко растворяются в воде: перкар-бонаты, перфосфаты. В воде, в нейтральной или кислой среде они разлагаются с образованием перекиси водорода. [26]
Многие перекиси и соли надкислот являются производными перекиси водорода. Некоторые из них малорастворимы, например, перекись бария ВаО2, другие легко растворяются в воде: перкарбонаты, перфосфаты. [27]
Раньше [1] было показано, что перекись водорода не участвует в анодном образовании персульфата и не является его промежуточным продуктом, а также что при гидролизе персульфата кислород воды не входит в образующуюся перекись водорода. В настоящей работе тяжелый изотоп кислорода О18 применен для изучения механизма анодного образования, гидролиза и термического распада перкарбоната, пербората и перфосфата. [28]
Ацетонитрильный раствор обеих кислот, охлажденный до 5 С для предотвращения окисления смолы, пропускали через колонку с сильноосновным анионитом Деацидит FF в ацетатной форме. Анионит сорбировал ( с частичным разделением) обе кислоты, затем колонку промывали 0 5 М раствором СН3СООК, подкисленным СН3СООН; последовательные фракции фильтрата содержали одно-замещенный фосфат и перфосфат калия, а также избыток ацетата. [29]
Его получают, растворяя на холоду одни моль пирофосфата натрия в трех молях концентрированной перекиси водорода. Образующийся раствор перфосфата натрия затем подвергают выпариванию под вакуумом. Перфосфат натрия является очень мягким окислителем, но он менее стоек, чем другие персоли. [30]
Страницы: 1 2 3