Перхлорат - литий
Cтраница 2
Вначале рассмотрим перхлорат лития, поскольку анион перхлората взаимодействует с катионами очень слабо, и влиянием этого взаимодействия на сольватацию ионов скорее всего можно пренебречь. [16]
Например, перхлорат лития может быть получен аналогично путем смешения концентрированных растворов хлористого лития и перхлората натрия при повышенной температуре для выделения большей части NaCl; перхлорат лития в виде тригидрата выпадает при охлаждении. [17]
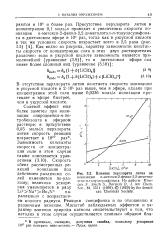 |
Влияние перхлората лития на. [18] |
В отсутствие перхлората лития константа скорости ионизации в уксусной кислоте в 2 - 104 раз выше, чем в эфире, однако при концентрации этой соли выше 0 0236 моль / л ионизация протекает в эфире быстрее, чем в уксусной кислоте. [19]
При добавлении перхлората лития происходит разрушение ионных пар. Полученные данные свидетельствуют о достаточно большой распространенности ионнопарного механизма. Это побудило многих ученых ( Снин, Скотт. На основании кинетических данных и в первую очередь того, что в ряде реакции нуклеофильного замещений соотношение продуктов не может быть описано в рачках конкурент... Сини высказал предположение, что все реакции нукло. [20]
Поскольку добавление перхлората лития снижает величину ka / kt, но не до единицы, то кажется вероятным, что в отсутствие добавок солей имеется два типа ионных пар, причем обе могут превратиться в исходный продукт с потерей оптической активности. Прибавленная соль может взаимодействовать с одним из этих двух типов, снижая степень его рекомбинации, а при достаточно высокой концентрации солей и полностью ее подавляя. [21]
За исключением перхлората лития ни один из перхлоратов щелочных металлов не имеет определенной температуры плавления. Они либо разлагаются без плавления, либо плавятся, образуя эвтектическую смесь перхлората и продуктов его разложения. Добавление Ba ( NO3) 2 к КСЮ4 ускоряет разложение последнего. [22]
Продукты реакции - перхлорат лития и хлорид натрия - разделяют дробной кристаллизацией. [23]
Прибавление к электролиту перхлората лития или других катионов, которые легко теряют заряд с образованием радикалов, облегчает превращение в аллиловые эфиры. Вследствие этого можно считать, что образование аллиловых эфиров протекает через отщепление атома водорода из аллильно-го положения радикалами, возникающими на аноде, с последующим окислением в аллильный карбениевый ион, который реагирует с растворителем. [24]
Отфильтрованные насыщенные растворы перхлората лития в растворителях разбавляют деминерализованной водой до конечной концентрации лития - 2 мкг в 1 мл. [25]
Прибавление к электролиту перхлората лития или других катионов, которые легко теряют заряд с образованием радикалов, облегчает превращение в аллиловые эфиры. Вследствие этого можно считать, что образование аллиловых эфиров протекает через отщепление атома водорода из аллильно-го положения радикалами, возникающими на аноде, с последующим окислением в аллильный карбениевый ион, который реагирует с растворителем. [26]
В системе метанол - перхлорат лития идет нормальное присоединение двух метоксигрупп по двойной связи инденовой системы, приводя к 2 3-диметокси - 1, 1 3-трифенилиндану. [27]
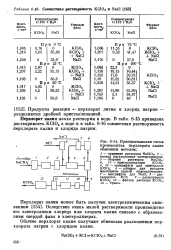 |
Совместная растворимость КеЮ4 и NaCl.| Принципиальная схема производства перхлората калия обменным методом. [28] |
Продукты реакции - - перхлорат лития и хлорид натрия - разделяются дробной кристаллизацией. [29]
Разложение таких окислителей как перхлораты лития и калия является весьма слабоэкзотер-мическим процессом. [30]
Страницы: 1 2 3 4