Перхлорат - литий
Cтраница 3
Предложено много вариантов получения перхлората лития через хлорную кислоту или ее соли, например, действием хлорной кислоты на гидроксид, карбонат или хлорид лития с отгонкой образующегося при этом НС1 нагреванием реакционной смеси. [31]
Растворяют 10 64 г перхлората лития Р в ледяной уксусной кислоте Р1 до получения 1000 мл. [32]
Предложено много вариантов получения перхлората лития через хлорную кислоту или ее соли, например, действием хлорной кислоты на гидроксид, карбонат или хлорид лития с отгонкой образующегося при этом НС1 нагреванием реакционной смеси. [33]
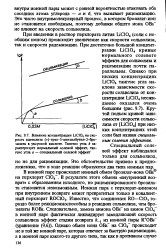
Наблюдаемый при меньших концентрациях перхлората лития резкий подъем ( специальный солевой эффект) демонстрирует подавление обратной реакции ионных пар, разделенных растворителем. Насыщение достигается здесь при концентрации 0 03 М LiClO4, что означает, что при этой концентрации СЮ. [34]
При введении в раствор перхлората лития LiClO4 ( соли с необщим ионом) происходит увеличение как скорости сольволиза, так и скорости рацемизации. При достаточно большой концентрации ЫС1О4 кривые нормального солевого эффекта для сольволиза и рацемизации почти параллельны. [36]
Тригидрат является обычной формой перхлората лития. Молярная теплота гидратации31 составляет 14 2 ккал / моль и гидратную воду весьма трудно удалить. [37]
 |
Влияние концентрации LiClO4 на ско - от концентрации LiClO4 неожиданно рость ацетолиза ( - трео-3 - анизилбутил-2 - бро. [38] |
При введении в раствор перхлората лития LiQC4 ( соли с необщим ионом) происходит увеличение как скорости сольволиза, так и скорости рацемизации. При достаточно большой концентр ации LiClC4 кривые нормального солевого эффекта для сольволиза и рацемизации почти параллельны. [39]
Предложено много вариантов получения перхлората лития через хлорную кислоту или ее соли. [40]
Тригидрат является обычной формой перхлората лития. Молярная теплота гидратации31 составляет 14 2 ккал / моль и гидратную воду весьма трудно удалить. [41]
Все эти соединения, кроме перхлората лития, являются диморфными; температуры превращения их из ромбической формы в кубическую помещены в табл. 12 ( стр. [42]
Все эти соединения, кроме перхлората лития, являются диморфными; температуры превращения их из ромбической формы в кубическую помещены в табл. 12 ( стр. [43]
Перхлорат серебра напоминает в этом отношении перхлорат лития; кроме того, вследствие комплексообразования он хорошо растворяется в бензоле. Тем не менее при распределении его между водой и бензолом он переходит в водную фазу. С другой стороны, в случае анилина координирование растворителя ионом серебра настолько велико, что перхлорат серебра экстрагируется из воды. Повышенная растворимость иода в некоторых растворителях, в том числе в ацетоне, обусловлена уменьшением концентрации свободного иода в растворителе благодаря образованию комплекса с переносом заряда. По аналогичным причинам любую систему, состоящую более чем из одного растворителя, необходимо рассматривать до некоторой степени эмпирически. [44]
Четко выраженную температуру плавления имеет только перхлорат лития. Остальные перхлораты разлагаются при температуре, близкой к температуре плавления или ниже ее. Некоторые термодинамические свойства перхлоратов аммония и щелочных металлов в растворах приведены в табл. 13 ( стр. [45]
Страницы: 1 2 3 4