Перхлорат - металл
Cтраница 1
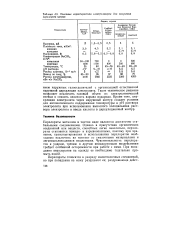 |
Основные характеристики электролизеров для получения перхлората натрия. [1] |
Перхлораты металлов в чистом виде являются достаточно стабильными соединениями. Однако в присутствии органических соединений или веществ, способных легко окисляться, перхлораты становятся пожаро - и взрывоопасными, поэтому при хранении, транспортировании и использовании перхлоратов необходимо исключить их контакт со смазочными материалами и легкоокисляющимися веществами. Чувствительность перхлоратов к ударам, трению и другим инициирующим воздействиям требует особенной осторожности при работе с ними. При попадании перхлоратов на одежду ее необходимо тщательно промыть водой. [2]
Перхлораты металлов и органические перхлораты будут рассмотрены в этом разделе далее; здесь мы рассмотрим реакции хлорной кислоты с органическими веществами, которые можно рассматривать как примеси, так как они широко распространены. [3]
Перхлораты металлов, образующиеся при удалении фторидов, разлагают сжиганием: конечные продукты содержат хлориды щелочных металлов, смеси хлоридов и оксидов щелочноземельных металлов, оксиды железа ( III) и алюминия. [4]
Перхлораты металлов и органические перхлораты будут рассмотрены в этом разделе далее; здесь мы рассмотрим реакции хлорной кислоты с органическими веществами, которые можно рассматривать как примеси, так как они широко распространены. [5]
Кроме перхлоратов металлов, описанных в предыдущих разделах, было получено значительное количество перхлоратов других металлов и изучены возможности их применения для различных целей. Однако сведения о термодинамических характеристиках этих соединений крайне ограничены. [6]
Из разнообразных перхлоратов металлов в значительных количествах выпускаются только перхлораты лития и калия. Прочие перхлораты используются как реактивы и производятся в крайне ограниченных количествах в основном из хлорной кислоты и соответствующих окислов или гидроокисей металлов. [7]
Из большого числа перхлоратов металлов в промышленных условиях получают только перхлораты лития и калия. [8]
Важное преимущество применения перхлората аммония вместо перхлоратов металлов состоит в том, что при взрыве в первом случае образуются только газообразные вещества, а во втором-как газообразные, так и твердые вещества. [9]
В табл. 16 включены теплоты образования производных хлорной кислоты - перхлоратов металлов, ацилперхлоратов и пер хлоратов органических оснований. [10]
Другим примером является получение кислорода и хлорида щелочного металла при разложении перхлоратов металлов. Но зцесь уже необходимо непрерывное нагревание препарата по заданной программе. [11]
 |
Растворимость перхлоратов аминов в воде43. [12] |
В главе III были описаны продукты, получаемые присоединением органических веществ к перхлоратам металлов, например продукты присоединения пиридина и комплексы бензола и толуола с перхлоратом серебра. В данном разделе будут рассмотрены общие свойства и дана характеристика только чисто органических перхлоратов, таких, как перхлораты аминов, соли оксонияг карбоння и диазония, сложные эфиры ( эфиры хлорной кислоты) и недавно открытые перхлорил-соединения. Бэтон и Прейл41 собрали хорошую библиографию и составили подробный литературный обзор по этим соединениям. [13]
В препаративных работах часто используют также осаждение труднорастворимого КС1О4 [203]; при этом исходят из перхлоратов металлов, которые все без исключения очень легко растворимы. Это можно использовать для перевода хорошо кристаллизующихся и поэтому более легко доступных солей калия в соли бария, используя Ва ( СЮ4) 2, а при помощи NaClO4 - в соли натрия. [14]
Ег /) л и Ei / t - потенциалы полуволны растворов, содержащих соответственно ионы металла без добавления лиганда ( например, раствор перхлората металла) и в присутствии лиганда; / ( р - суммарная константа образования комплекса; сх - общая концентрация лиганда. [15]
Страницы: 1 2