Перхлорат - тетраэтиламмоний
Cтраница 2
Перхлорат тетраэтиламмония, однако, почти не действует на 2-октилбромид, при тех температурах, когда происходит реакция с перхлоратом серебра, в которой первоначально образуются 2-октшшерхлорат и октены. Добавление перхлората тетраэтиламмония лишь немного увеличивает скорость. Очевидно, что не входящие в ионные пары перхлорат-ионы обладают недостаточной нуклеофильностью и не могут содействовать ионизации субстрата. [16]
Интересно отметить влияние природы анионов на электрохимический процесс. Нитрат цинка в перхлорате тетраэтиламмония дает обратимую волну при потенциале - 0 70 в ( нас. [17]
Интересно отметить влияние природы анионов на электрохимический процесс. Нитрат цинка в перхлорате тетраэтиламмония дает обратимую волну при потенциале - 0 70 в ( нас. [18]
Даже в столь отличных от воды растворителях, как ацетонитрил [3, 4] и диметилсульфоксид [5, 6], определение рН с помощью стеклянного электрода, по-видимому, приводит к полезной характеристике кислотности. В обоих случаях в качестве солевого мостика рекомендуется 0 1 М раствор перхлората тетраэтиламмония в исследуемом растворителе, а в качестве электрода сравнения - серебро в растворе серебряной соли в том же растворителе. [19]
Меняются не только количественные параметры электродных процессов, но и механизм при замене одного фона на другой. Так, восстановление ионов Са2, Sr2 и Ва2 в диметилацетамидных растворах в присутствии перхлората тетраэтиламмония или вовсе не происходит, или же происходит с малым предельным током и контролем предшествующим процессом. [20]
Меняются не только количественные параметры электродных процессов, но и механизм при замене одного фона на другой. Так, восстановление ионов Са2, Sr2 и Ва2 в диметилацетамидных растворах в присутствии перхлората тетраэтиламмония или вовсе не происходит, или же происходит с малым предельным током и контролем предшествующим процессом. [21]
Однако помимо этого ожидаемого эффекта полярографическое поведение солей пиридиния существенно зависит от природы фонового электролита. На фоне перхлората лития потенциалы волны не зависят от источника пиридиниевого иона, тогда как на фоне перхлората тетраэтиламмония потенциалы полуволны зависят от того, в состав какой соли входит пиридиниевый ион. [22]
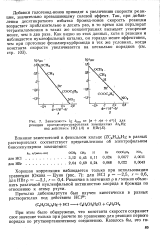 |
Зависимость lg. отн от. [23] |
Добавки галогенид-ионов приводят к увеличению скорости реакции, значительно превышающему солевой эффект. Так, при добавлении десятикратного избытка бромид-ионов скорость реакции возрастает приблизительно в десять раз, в то время как перхлорат тетраэтиламмония в таких же концентрациях вызывает ускорение менее, чем в два раза. Как видно из этих данных, хотя в реакции и наблюдается нуклеофильный катализ, он гораздо менее эффективен, чем при протолизе фенилмеркурбромида в тех же условиях, когда константа скорости увеличивается на несколько порядков ( см. стр. [24]
Между тем иногда случается и обратное. Формальные электродные потенциалы пар Cu / Cu ( Hg) и Ag / Ag ( Hg) в 0 1 М растворе перхлората тетраэтиламмония в ацетонитриле соответственно составляют - 0 52 и 0 23 В относительно водного НКЭ без диффузионного потенциала ( Т1 в качестве пилотного иона) [5], а стандартные электродные потенциалы этих пар в воде - соответственно 0 15 [166] и больше 0 4 В [160] относительно водного НКЭ. Ацетонитрил комплексует ионы меди ( 1) и серебра ( I) сильнее, чем вода. Эти эффекты известны как специфические и довольно необычны. [25]
На вспомогательном электроде выделяется галогенид серебра, который, хотя и несколько растворим, обычно не дает осложнений. В случае хлоридов и бромидов, подобно водным растворам, большинство солей остается связанным с анодом. Если перхлорат тетраэтиламмония ( ПТЭА) выступает в роли среды для восстановительных реакций, то катодная реакция сопровождается выделением триэтиламина и газов-г по-видимому, смеси водорода и метана. [26]
Приведенный механизм основан исключительно на данных полярографии. Восстановление может затрагивать скорее положения 1 и 2, чем то, которое показано. В диметилформамиде на фоне перхлората тетраэтиламмония хинолин восстанавливается в две стадии. [27]
Для проведения восстановительных реакций в качестве фоновых электролитов обычно применяются галогениды с серебряным вспомогательным электродом, что позволяет сдвинуть лимитирующий катодный потенциал к высоким значениям. На вспомогательном электроде выделяется галогенид серебра, который, хотя и несколько растворим, обычно не дает осложнений. В случае хлоридов и бромидов, подобно водным растворам, большинство солей остается связанным с анодом. Если перхлорат тетраэтиламмония ( ПТЭА) выступает в роли среды для восстановительных реакций, то катодная реакция сопровождается выделением триэтиламина и газов - по-видимому, смеси водорода и метана. [28]
Поскольку электрохимическое окисление цианид-иона требует высокого перенапряжения на платиновом электроде, можно выбрать потенциал Е так, чтобы окислялись только органические молекулы. Анодно-генерированные ароматические катион-радикалы способны химически окислять цианид-ион. Реакция была исследована на примере ТАА и цианида тетраметиламмония в ацетонитриле с использованием в качестве фонового электролита перхлората тетраэтиламмония. [29]
Коци и Падманабхан [91] показали, что по крайней мере часть экспериментальных трудностей, возникающих при применении в ацетонитриле стеклянного электрода, может быть связана с нестабильностью солевого моста и электрода сравнения. Обычный солевой мост из водного раствора агар-агара и хлористого калия постепенно портится, и это приводит к увеличению сопротивления гальванического элемента. Хорошие результаты были получены с серебряным электродом сравнения в 0 01 М растворе нитрата серебра в ацетонитриле; солевой мост, используемый для соединения с этим электродом, состоял из 0 1 М раствора перхлората тетраэтиламмония в ацетонитриле. [30]
Страницы: 1 2 3