Пиренхинон
Cтраница 1
Пиренхинон, пирен 1 6 - и 1 8-хинон, CieHsCh, горючий красно-коричневый порошок. [1]
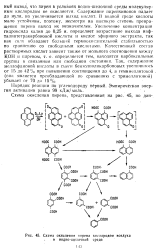 |
Схема окисления пирена кислородом воздуха в водно-щелочной среде. [2] |
Содержание пиренхинонов падает до нуля, но увеличивается выход кислот. В водной среде кислоты мало устойчивы, поэтому, несмотря на высокую степень превращения пирена выход их незначителен. [3]
Окисление пиренхинона гипохлоритом натрия идет по следующей схеме. [4]
Приведенные способы получения пиренхинона сопровождаются интенсивным повышением температуры реакции и частыми выбросами реакционной массы. Резкое повышение температуры, по-видимому, оказывает влияние и на выход пиренхинона. [5]
Первый этап процесса - получение пиренхинона - известен с 1870 г., когда Гребе в результате окисления пирена получил смесь 3 8 -, 3 10-пиренхинонов и пиреновой кислоты. [6]
Практический интерес представляет окисление пирена с получением пиренхинона или нафталинтетракарбоновой кислоты. [7]
II, 3832 ] дает рецепт получения пиренхинона путем окисления пирена хромовой смесью при нагревании. [8]
В этом случае выход нафталинтетра-карбоновой кислоты из очищенного пиренхинона достигает 50 %, а из неочищенного 43 / 5 в расчете на IOO / 5-ный пирен. [9]
Использование смеси хлорной извести и гидроокиси кальция для окисления пиренхинона [62, 81], по-видимому, нельзя считать целесообразным, так как максимальный выход нафталинтетракарбоно-вой кислоты в этом случае не превышает 31 / 5 в расчете на IOO / 5-ный пирен, а кислота получается темного цвета. [10]
II, 2447 ] для приготовления нафталин-1, 4, 5, 8-тетракарбоновой кислоты, не содержащей галогена, пиренхинон в тонко измельченном состоянии обрабатывается при температуре до 100 щелочью и окислителем - лучше всего гипохлоритом. Прибавка ничтожного количества нафталина действует благоприятно. [11]
Этот способ позволяет вести процесс с меньшими объемами реакционной массы и обеспечивает выход кислоты 70 - 80 / 5 в расчете на пиренхинон. [12]
Age 30, 6764 ( 1936) ] указывает на то, что при действии гипохлорита в присутствии щелочи и при температуре от комнатной до 100 на пиренхинон образуется 1 4 5 8-нафталинтетракарбоновая кислота. [13]
Дальнейшее окисление 6в приводит к 1 8-перинафтенон - 4 5-дикарбоновой кислоте LXIV, дающей при декарбоксилировании перинафтенон LXV, и нафталин-1 4 5 8-тетра-карбоновой кислоте LXVI. Позднее было показано, что получаемый пиренхинон является смесью двух хинонов, которые могут быть разделены в виде диацетатов соответствующих диоксипиренов. [14]
В случае использования в качестве исходного сырья пирена его подвергают либо окислению, либо галоидированию с последующим окислением. В первом случае окисление идет через стадию образования пиренхинона, который при дальнейшем окислении превращается в нафталин-1 4 5 8-тетракарбоновую кислоту. При галоидировании пирена образуются тетрагалоидпирены, которые при последующем окислении превращаются в нафталин-1 4 5 8-тетракарбоновую кислоту. [15]
Страницы: 1 2