Пиросульфат - натрий
Cтраница 3
При определении содержания ниобия абсолютным методом отбирают аликвотную часть прозрачного раствора ( 5 мл), содержащую 300 - 450 мкг ниобия, в мерную колбу вместимостью 50 мл, содержание тартрата аммония доводят его 4 % - ным раствором до 400 мг, пиросульфата натрия - 4 % - ным раствором его соли до 200 мг, затем прибавляют - 15 мл воды, 5 мл комплексона III, 8 5 мл 6 М раствора соляной кислоты, 6 мл раствора ПАР. [31]
В настоящее время испытаны препараты: АЙВ, ААЗ, С-2, ВИК, К-2, ИБ-2, кислотная и кислотно-солевая смесь, тиомочевина, бисульфит аммония, бисульфат аммония, хлористый аммоний, дигидрофосфат аммония, моногидро-фосфат аммония, мочевина, пиросульфит натрия, бисульфат натрия, пиросульфат натрия, персульфат аммония, нитрит натрия, гидросульфит натрия, сульфит натрия, карбонат натрия, пндолилуксусная кислота, индолил-масляная кислота, симазин, атразин, 2 - 4Д, фенплдпметил-мочевина, трихлорацетат натрия, карбонат аммония, бикарбонат аммония, аммиак и др., а также более 15 смесей этих веществ в разных количественных и качественных комбинациях. Изучалось влияние на сохранность кормов углекислоты, молекулярного азота, вакуума и более 20 препаратов, специально синтезированных для этой цели Институтом общей химии Академии наук СССР и Всесоюзным научно-исследовательским институтом физиологии и биохимии сельскохозяйственных животных. [32]
Пиросульфаты являются термически устойчивыми при более низких температурах по сравнению с комплексными сульфатами. Пиросульфат натрия существует при температурах ниже 600 - 680 С, а заметное разложение пиросульфата калия начинается с температур 700 С. Судя по этим данным, Пиросульфаты щелочных металлов при существующих концентрациях SO3 в продуктах сгорания энергетических топлив могут находиться лишь в твердом состоянии. По этим данным в системе Na2SO4 - SO3 жидкая фаза может образовываться начиная от концентрации SOs 0 25 % при температуре 397 С, а в системе K2SO4 - SO3 - при концентрации SO30 01 % и г407 С. [33]
При применении пиросульфата калия конец растворения всегда легко определить ( даже когда жидкость имеет темно-красную окраску и непрозрачна), перенеся тигель к свету и дав ему охладиться; во время охлаждения жидкость на одно мгновение становится прозрачной, и, таким образом, можно разглядеть дно тигля. При применении пиросульфата натрия это явление выражено не так резко. [34]
Пиросульфат натрия плавится быстрее, чем пиросульфат калия, и образует более растворимые двойные соли с алюминием и с некоторыми другими металлами. Разложение минералов пиросульфатом натрия идет не так быстро вследствие большой склонности натриевой соли создавать корку на поверхности плава; указанная особенность пиросульфата натрия является его небольшим недостатком. [35]
Один из исследователей3 считает, что отделение ниобия я тантала от железа и марганца, а также тантала от ниобия можно выполнить следующим способом. Танталат сплавляют с девятикратным количеством пиросульфата натрия при 835 - 875 С. После этого осадок обрабатывают разбавленной ( 1: 1) серной кислотой и кипятят до тех пор, пока объем раствора не уменьшится до одной трети. [36]
К анализируемому раствору прибавляют несколько капель серной кислоты и выпаривают сначала на водяной бане, потом на песочной бане. При этом может остаться немного пиросульфата натрия. Превращение его в сульфат облегчается добавлением небольших количеств твердого карбоната аммония, которые, реагируя с пиросуль-фатом, образует летучий сульфат аммония. При 400 - 700 С в прокаленном остатке остается только 0 1 % воды. Не следует подымать температуру выше 800 С. Плавится сульфат натрия при 884 С. [37]
К анализируемому раствору прибавляют несколько капель серной кислоты и выпаривают сначала на водяной бане, потом на песочной бане. При этом может остаться немного пиросульфата натрия. Превращение его в сульфат облегчается добавлением небольших количеств твердого карбоната аммония, который, реагируя с пиросульфатом, образует летучий сульфат аммония. При 400 - 700 С в прокаленном остатке остается только 0 1 % воды. Не следует подымать температуру выше 800 С. Плавится сульфат натрия при 884 С. [38]
Кроме того, при проведении ряда операций силикатного анализа платина несколько растворяется. Это особенно заметно при сплавлении с пиросульфатом натрия или калия, когда в зависимости от применяемой температуры и длительности операции обычно растворяется несколько миллиграммов платины. [39]
Для растворения сплавов, содержащих цирконий, используют фтористоводородную кислоту или ее смесь с азотной кислотой. Разложение сплавов удобно проводить также сплавлением с пиросульфатом натрия или калия и последующим растворением плава в растворе органической кислоты. [40]
При анализе руд 0 5 г пробы помещают в платиновую чашку и растворяют при нагревании в 10 мл фтористоводородной кислоты ( р 1 13) и 10 мл серной кислоты, разбавленной 1: 1, а затем упаривают досуха. Остаток сплавляют при температуре 800 С с 2 г пиросульфата натрия. Плав растворяют в 25 мл 16 % - ного раствора тартрата аммония при нагревании, раствор охлаждают, переводят в мерную колбу вместимостью 500 мл и доводят водой до метки. Аликвотную часть раствора, содержащую от 2 до 25 мкг тантала, помещают в кварцевый цилиндр, объем доводят до 5 мл 8 % - ным раствором тартрата аммония, добавляют 2 мл серной кислоты ( 1: 4) и далее поступают, как указано при построении градуировочного графика. [41]
Из рассмотрения диаграммы ( рис. 9 - 6) видно, что чистый Ма2Ре ( 5О4) з налипает начиная с 640 С. При смешении егосЫа25О4 температура налипания быстро понижается вследствие образования пиросульфата натрия. В левой части диаграммы линия конца налипания и линия плавления совпадают друг с другом, в правой части между ними имеется промежуточная область, в которой налипания не происходит. [42]
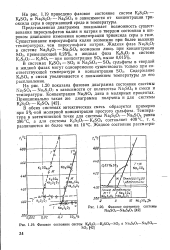 |
Фазовое состояние системы Na2S04 - Na2S207.| Фазовое состояние систем Кг520. - KsSO4 - SOs и Na2SjO7 - Na2SO4. [43] |
Представленная диаграмма показывает возможность существования пиросульфатов калия и натрия в твердом состоянии в широком диапазоне изменения концентрации триоксида серы в газе. Существование пиросульфата калия возможно при более высоких температурах, чем пиросульфата натрия. [44]
Грязные тигли и чашки очищают, промывая их в конц. Если при этом тигель не очищается, то в нем расплавляют пиросульфат натрия Na2S2C7 и держат в расплавленном состоянии при возможно более низкой температуре 5 - 10 мин. Расплавленную массу затем выливают в сухой песок, прежде чем она затвердеет. После этого тигель снова обрабатывают горячей конц. Рекомендуется также очищать платиновые тигли и чашки плавлением в них хлорида магния-аммония ( MgCh - 2NH4Cl) при 1100 - 1200 С. После выщелачивания плава водой платиновое изделие становится белым и блестящим. После повторных прокаливаний поверхность платины иногда становится серой и утрачивает блеск, что связано с начинающимся процессом рекристаллизации платины. В этих случаях рекомендуется поверхность платинового тигля или чашки время от времени осторожно протирать тонким кварцевым песком. Для этого порцию кварцевого песка, просеянного через сито с отверстиями в 0 1 мм, наносят на влажный ватный тампон и, слегка прижимая пальцем, полируют им внутреннюю поверхность тигля или чашки до появления металлического блеска, после чего промывают НС1 и дистиллированной водой. [45]
Страницы: 1 2 3 4