Пирофорность
Cтраница 1
 |
Вид тряпок, пропитанных льняным маслом. [1] |
Пирофорность появляется у металлов, покрывающихся на воздухе при обыкновенной температуре пленкой окислов; если выделение тепла при наличии высокой дисперсности идет интенсивно и достигается температура красного каления, то металл пирофорен. [2]
 |
Вид тряпок, пропитанных льняным маслом. [3] |
Пирофорность приобретается металлами не только при измельчении их, но и при ином способе увеличения поверхности. Так, известно, что скелетные катализаторы, например, так называемый никель Ренея, являются пирофорными, хотя обычный металл в такой же степени измельчения безопасен. Хранение скелетных катализаторов под водой, спиртом и некоторыми другими инертными к влиянию катализатора жидкостями устраняет опасность самовозгорания. [4]
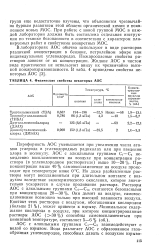 |
Физические свойства некоторых АОС. [5] |
Пирофорность АОС уменьшается при увеличении числа атомов углерода в углеводородных радикалах или при введении хлора в молекулу. При концентрации выше 40 % самовоспламенение на воздухе происходит при температуре ниже 0 С. Но даже разбавленные растворы могут воспламеняться при длительном контакте с воздухом вследствие экзотермического окисления, которое значительно ускоряется в случае проливания раствора. Они дымят на воздухе, самовоспламенение возможно только при высокой влажности воздуха. Контакт этих растворов с воздухом, обогащенным кислородом ( больше 21 %), может привести к взрыву. [6]
Пирофорностью называется способность некоторых металлов ( Fe, Co, Ni, редкоземельные элементы) в мелкораздробленном состоянии самовоспламеняться на воздухе при комнатной температуре. [7]
Пирофорностью называется способность некоторых веществ ( Fe, Со, Ni, редкоземельные элементы) в мелкораздробленном состоянии самовоспламеняться на воздухе при комнатной температуре. [8]
Предполагаемой причиной пирофорности мелкодисперсного металла является выделение тепла при образовании окисной пленки, достаточного для воспламенения металла. [9]
Высокая стоимость и пирофорность низших гомологов ряда ЛЩ8 затрудняют промышленное оформление этого способа. Он может оказаться перспективным при использовании высших, менее пирофорных алюминий алии лов, например триоктил-алюминия. [10]
В связи с пирофорностью тонко измельченного титана, гафния, и особенно циркония, необходимо соблюдать осторожность при всех механизированных операциях. Тантал и ниобий менее пирофорны, чем титан. [11]
Хлорпроизводные ДОС также проявляют меньшую пирофорность, чем соответствующие алюми-ний-алкилы. Пожарная опасность АОС повышается при наличии в них производственного шлама, содержащего непрореагировавший алюминий. [12]
Хлорпроизводные АОС также проявляют меньшую пирофорность, чем соответствующие алюми-ний-алкилы. Пожарная опасность АОС повышается при наличии в них производственного шлама, содержащего непрореагировавший алюминий. [13]
Компактный цирконий не обладает пирофорностью. Он отличается высокой коррозионной стойкостью во многих агрессивных средах, в том числе в ряде сильных кислот и щелочей. На цирконий не действуют концентрированные соляная и азотная, а также органические кислоты даже при нагреве до 100 С. По коррозионной стойкости в соляной кислоте цирконий превосходят только тантал и благородные металлы. Серная кислота при концентрации ниже 70 % слабо действует на цирконий, но с повышением концентрации скорость реакции резко возрастает. Плавиковая и концентрированная фосфорная кислоты, а также царская водка растворяют цирконий. Хлорная вода, бромная вода и 10 % - ный раствор FeCls при комнатной температуре быстро вызывают точечную коррозию металла. [14]
Компактный цирконий не обладает пирофорностью. Он отличается высокой коррозионной стойкостью во многих агрессивных средах, в том числе в ряде сильных кислот и щелочей. На цирконий не действуют концентрированные соляная и азотная, а также органические кислоты даже при нагреве до 100 С. По коррозионной стойкости в соляной кислоте цирконий превосходят только тантал и благородные металлы. Серная кислота при концентрации ниже 70 % слабо действует на цирконий, но с повышением концентрации скорость реакции резко возрастает. Плавиковая и концентрированная фосфорная кислоты, а также царская водка растворяют цирконий. Хлорная вода, бромная вода и 10 % - ный раствор FeCb при комнатной температуре быстро вызывают точечную коррозию металла. [15]
Страницы: 1 2 3 4