Пирохлор
Cтраница 1
Пирохлор - минерал по химическому составу весьма сложный. Он представляет собой соль ниобиевой и титановой кислот ( титанониобат), в которой катионами являются натрий, кальций, редкоземельные и ряд других редких элементов. Кроме того, минерал содержит фтор. [1]
Пирохлор, NaCaNb2O6F, имеет вид коричневых октаэдрических кристаллов с плотностью 4 03 - 4 36 г / см3 и твердостью 5 - 5 5 но шкале Мооса. [2]
Пирохлор очень похож на циркон, с которым образует иногда сростки, а также на шеелит, от которого отличается отсутствием спайности. [3]
Пирохлор, коппит и особенно лопарит представляют собой ценное комплексное сырье для получения ниобия и редких земель. [4]
Запасы пирохлора в Канаде и Норвегии оцениваются свыше 400 000 и 500 000 т соответственно. [5]
Структура пирохлора, очевидно, должна обладать большими возможностями для образования анионных вакансий, потому что, как об этом уже было сказано, седьмые ионы кислорода у пирохлоров не играют существенной роли в построении решетки. [6]
Извлечение пирохлора и апатита и, следовательно, ниобия фосфора в концентрат зависит от верхнего предела крупности о деляемой иловой суспензии. [7]
Фаза пирохлора становится неустойчивой, когда R уменьшается до предельного значения RL 1 2, что соответствует предельной доле замещенных ионов. Приведенные в табл. 5 экспериментальные и расчетные значения XL для систем ZrO2 - Nd2O3, ZrO2 - Sm2O3 и ZrO2 - Gd2O3 превосходно согласуются между собой. В системе ZrO2 - La2O3 размеры катионов различаются более чем на 25 %, и это различие ограничивает возможность замещения. Таким образом, можно рассчитывать размеры области гомогенности нестехиометрической фазы, когда эта фаза образуется путем разупорядоче-ния из твердого раствора. [8]
В пирохлоре образуется 486 л газа в расчете на 1 кет ч энергии дуги. Такие расхождения, очевидно, связаны с различиями в условиях эксперимента. [9]
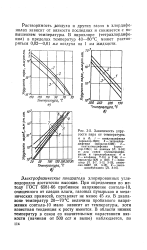 |
Зависимость упругости пара от температуры. [10] |
В пирохлоре ( тетрахлордифе-нил) в пределах температур 40 - 80 С может растворяться 0 02 - 0 01 мл воздуха на 1 мл жидкости. [11]
В пирохлоре содержится 41 1 % суммы пятиокисей ниобия п тантала, 3 3 % окиси тория и 3 1 % окиси урана. Следует, однако, учесть, что разрешение технологического процесса обработки этих руд связано с большими трудностями. [12]
В пирохлоре содержания титана и урана составляют: 6 - 8 % Ti () 2 и до 3 % U02 иОз; бетофите: 7 - 12 5 % ТЮ2 и 12 - 23 %, U02 UOs, т.е. бетофит более богат этими элементами, чем пирохлор. Богатые залежи пирохлора ( 70 %) находятся в Бразилии, а ильме-нитовых и рутиловы руд ( 6 % ТЮ2) - на среднем Урале. [13]
О сульфатизации пирохлора и сфена. [14]
Выделенная из пирохлора кислота, которую Велер принял за танталовую, наряду со свойствами, изученными к тому времени, проявляла и другие существенно отличные свойства. [15]
Страницы: 1 2 3 4