Гладкая платина
Cтраница 2
В качестве анода применяется только гладкая платина в виде фольги или сетки. Анодная плотность тока допускается 3000 А / м2 и выше. Катоды обычно изготовляют из стали Ст. Исходный раствор содержит 20 - 40 г / л буры и 140 - 160 г / л соды. Поскольку в процессе электролиза из-за потерь двуокиси углерода увеличивается разряд ионов ОН -, то для компенсации потерь в раствор периодически добавляют соду. [16]
Хингидронный электрод получают погружением гладкой платины в исследуемый раствор, насыщенный хингидроном. [17]
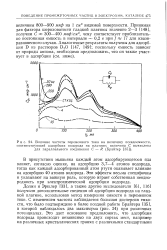 |
Влияние частоты переменного тока на величину псевдоемкости. [18] |
Принимая для фактора шероховатости гладкой платины значение 2 - 3 [148], получим С яа 300 - 400 мкф / см2, чему соответствует приблизительно постоянная емкость в интервале - 0 2 в при / ж 17 для квазиравновесного случая. [19]
В качестве анодов применяют гладкую платину. С целью экономии платины из нее выполняют только рабочую часть анода, где проходит собственно процесс окисления. [20]
Такому условию отвечают аноды из гладкой платины. [21]
Разность потенциалов водородного электрода и гладкой платины зависит в одном том же растворе только от разности давлений водорода над электродами. [22]
Если в качестве электрода употреблять гладкую платину, на которой имеет место высокое перенапряжение хлора, то при технических плотностях тока анодный потенциал будет близок к 2 1 вольта; тогда в сумме падение напряжения на двух электродах составит 3 9 вольта. К этому следует прибавить падение напряжения в электролите, определяемое концентрацией рассола, расстоянием между электродами, температурой и плотностью тока. Применяемая плотность тока, как сказано, бывает достаточно высока, поэтому электроды выгоднее располагать между собой близко ( примерно 10 - 20 мм) и упот - реблять крепкий рассол. [23]
В качестве анодного материала применяют исключительно гладкую платину, в качестве катодов - оловянные спиральные змеевики, окружающие анод и охлаждаемые водой. [24]
Эта реакция становится возможной на гладкой платине, благодаря высокому перенапряжению выделения кислорода па этом металле. [25]
Механизм суммарной электродной реакции на гладкой платине должен состоять из сложной последовательности реакций. Фет-тер Б9 выяснил механизм реакции этого электрода. Характерно возникновение анодной предельной плотности тока диффузии гд, которая зависит от интенсивности перемешивания электролита и катодной предельной плотности тока реакции tp, не зависящей от перемешивания. [26]
 |
Поляризационные кривые, иллюстрирующие процессы при электролизе водного раствора CuSOi с медными электродами. [27] |
Самым незначительным оказывается перенапряжение водорода на гладкой платине. На электроде из черненой платины водород выделяется без перенапряжения. По теории А. Н. Фрумкина ( 1933), перенапряжение водорода обусловлено восстановлением его ионов, как наиболее медленной стадии всего процесса. [28]
Абсолютные значения емкости двойного слоя на гладкой платине и некоторых других гладких металлических электродах меняются примерно в пределах от 10 до 40 мкф. Если вместо гладкой платины взять платинированную платину, то емкость двойного слоя при расчете на геометрическую ( видимую) поверхность возрастает в 1000 раз. [29]
Самым незначительным оказывается перенапряжение водорода на гладкой платине. На электроде из черненой платины водород выделяется без перенапряжения. По теории А. Н. Фрумкина 1933), перенапряжение водорода обусловлено восстановлением его ионов как наиболее медленной стадии всего процесса. [30]
Страницы: 1 2 3 4