Плотность - анодный ток
Cтраница 3
Где / а - плотность анодного тока; Ik - плотность катодного тока; Ki и Кг - - константы скоростей анодного и катодного процессов; аи Р - коэффициенты, характеризующие работу процесса ( их чсумма равна единице, а экспериментально установлено, что а, в 3 / 2); ф0 и фл. [31]
ГДе id & - плотность предельного анодного тока, обусловленного диффузией комплексов, коэффициенты диффузии которых принимаются одинаковыми. [32]
При дальнейшем незначительном увеличении плотности анодного тока потенциал резко смещается в положительную сторону и начинается третий анодный процесс - выделение кислорода. Основной реакцией, определяющей скорость анодного растворения железа, является его взаимодействие с гидроксильными ионами, в результате чего железо переходит в раствор в виде анионов HFeOiL которые затем гидроли-зуются до Fe ( OH) 2 - Однако образование непрочного осадка гидроокиси двухвалентного железа не может служить причиной пассивации металла. [33]
При ца 0 025 в плотность анодного тока очень велика. Это может привести к побочным явлениям концентрационной поляризации и нагревания. Кроме того, если ( nzFrla / J близка по величине к ДОЙ, то первое слагаемое в уравнении ( 7) перестает быть правильным. [34]
При создании условий, когда плотность анодного тока на свежеобразованной поверхности близка к плотности, которая была после разрыва оксидной пленки ( т.е. металл находится в активном состоянии, и защитная пленка-или не растет, или постоянно пробивается), происходит электрохимическое и химическое растворение активного металла. [36]
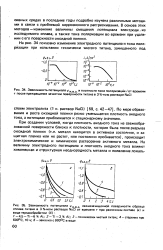
Для построения графика необходимо знать плотность анодного тока насыщения / э и температуру катода. Расчет температуры производится следующим образом. Подводимая к катоду мощность расходуется в вакуумной лампе в основном на тепловое излучение. Для вольфрама была экспериментально определена зависимость температуры катода от расходуемой на его нагрев мощности, приходящейся на единицу площади поверхности катода. На графике, который прилагается к работе, приведены результаты этих измерений. [37]
На основании данных о величине плотности анодного тока, площади анодной петли разрабатывают экспрессные количественные и полуколичественные электрохимические методы оценки склонности сталей к МКК. NaCl при комнатной температуре, постоянном потенциале 0 3В в течение 15 мин и последующем загибе образцов. [38]
Коэффициент полезного действия протекторов зависит от плотности анодного тока, материала протектора и состава активатора и определяется по каталожным данным протекторов. [39]
Интенсивность коррозии зависит в основном от плотности анодных токов. [40]
Условные обозначения: / а - плотность анодного тока; t - температура электролита; т - время обработки. [41]
Скорость растворения отдельных учаетаов определяется величиной плотности анодного тока на структурных составляющих и физически неоднороднвгх участках металла. [42]
Особое внимание следует обратить на выбор плотности анодного тока и времени анодной поляризации. При высоких плотностях анодного тока могут протекать несколько электрохимических реакций, что усложняет расчет парциальных токов растворения компонентов, а также появляются трудности при расшифровке задержек на р, т - кривых при катодной поляризации. Время анодной поляризации также не должно быть большим, так как образующиеся продукты анодной реакции могут диффундировать в объем раствора и их восстановление при катодной поляризации исключается. Правда, когда образуются труднорастворимые анодные продукты, то время анодной поляризации может быть увеличено. Но и оно ограничено, так как нерастворимые анодные продукты могут отслаиваться от электрода. Так, при изучении анодного растворения твердых растворов системы Ag - Zn, Ag - Cd и других в хлоридных растворах время анодной поляризации при плотности тока 0 6 ма / см может доходить до 60 - 70 сек. При исследовании сплавов системы Си - Zn, Си - Cd, Си - Sn и других это время не должно превышать 5 - 10 сек. [43]
Естественно, что использовать различие в плотностях анодных токов для рассматриваемой цели можно лишь в том случае, когда увеличение плотности анодного тока обусловлено исключительно избирательным растворением материала границ зерен, в частности, обедненных хромом. [44]
Аналогичные относительные коэффициенты могут быть получены по плотности анодного тока из поляризационных кривых. [45]
Страницы: 1 2 3 4