Я-электронная плотность
Cтраница 3
Таким образом, в бутадиене я-электронная плотность на каждом атоме равна единице. [31]
Однако некоторые ароматические соединения, я-электронная плотность которых сильно уменьшена электроноакцепторными группами, оказываются в состоянии взаимодействовать не с электрофильными, а с нуклеофильными реагентами. В результате такого взаимодействия из ароматического субстрата вытесняется анион. [32]
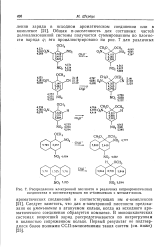 |
Распределение электронной плотности в различных нитроароматических соединениях и соответствующих им сг-комплексах с метилат-ионом. [33] |
Следует заметить, что для я-электронной плотности предсказано ее уменьшение в атакуемом кольце, когда из исходного ароматического соединения образуется комплекс. В моноциклических системах возросший заряд рассредоточивается по нитрогруппам в полностью сопряженном кольце. [34]
Они различаются не только распределением я-электронной плотности, но и положением атома водорода: в кето-форме он связан с углеродом, в енолъной форме-с кислородом. Геометрические характеристики этих форм, конечно, различны. В подобном случае следует говорить не о резонансе, а о таутомерии. В отличие от резонансных структур, таутомеры-это реально существующие соединения, которые обычно можно отделить друг от друга. В приведенном выше примере в равновесной таутомерной смеси преобладает кетонная форма, поскольку она на 58 8 кДж / моль стабильнее енольной, но обе формы являются, в отличие от резонансных структур, реальными, экспериментально наблюдаемыми соединениями. [35]
Квантовая механика дает возможность вычислить я-электронную плотность q у различных атомов молекулы. В случае ароматических соединений я-электронная плотность у атомов углерода в молекуле бензола принимается за единицу. [36]
Напротив, в системах с пониженной я-электронной плотностью гетероатом оказывает инактивирующее ( азот в пиридине) влияние. [37]
В данном случае показано, что я-электронная плотность двойной 1 2-связи нафталина больше, чем 2 3-связи. Эта реакция приводит предпочтительно к - замещенному соединению. [38]
В последней колонке табл. 9.7 приведены я-электронные плотности, вычисленные с помощью метода Попла. Правда, эти данные не особенно надежны из-за того, что для бора, как уже указывалось выше, определить параметры довольно трудно. Однако расчеты с использованием интервала значений параметров приводят к одинаковым результатам. Можно сразу отметить, что изменение я-электронной плотности оказывается качественно иным, чем в методе МОХ, причем достигается общее соответствие со спектром ЯМР. Так, я-электронная плотность в положении 1 по этим данным не минимальна, а почти что наибольшая, а электронная плотность в положении 4, вместо того, чтобы быть наибольшей, оказалась чуть ли н-е наименьшей. [39]
Метод МО дает возможность получить картину распределения я-электронной плотности в молекуле. В настоящее время для многих молекул рассчитаны так называемые молекулярные диаграммы, в которых указываются электронные, или эффективные заряды, характеризующие относительную величину электронной плотности вокруг данного атома, порядки связей и индексы свободной валентности атомов, отражающие степень ненасыщенности. [40]
Таким образом, все электроноакцепторные заместители уменьшают я-электронную плотность ароматического кольца, особенно орте - и пара-положений, и, следовательно, затрудняют течение реакций с электрофильными агентами. Эти реакции проходят преимущественно в жега-положения, которые дезактивируются в меньшей степени. [41]
Таким образом, все электроноакцепторные заместители уменьшают я-электронную плотность ароматического кольца, особенно орто - и ара-положений, и, следовательно, затрудняют течение реакций с электро фильными агентами. Эти реакции проходят преимущественно в мета-положения, которые дезактивируются в меньшей степени. [42]
 |
Электронный спектр поглощения бензола в растворе ци-клогексана. [43] |
Как показывают расчеты МО, заместители вызывают изменения я-электронной плотности на углеродных атомах бензольного кольца. Электронодонорные заместители D: ( алкильные группы, атомы с неподеленными парами электронов) увеличивают плотность электронов на о - и л-углеродных атомах, напротив, электроноакцептор-ные заместители А ( группировки с гетероатомами О, N, содержащие двойные и тройные связи) уменьшают электронную плотность на о - и n - углеродных атомах. [44]
Заместители первой группы обладают электронодонорным характером и увеличивают я-электронную плотность ароматического кольца, заместители второй группы действуют в противоположном направлении, оказывают электроноакцепторное влияние. Как электронодонорное, так и электроноакцепторное влияние заместителей является результатом их индуктивного эффекта и эффекта сопряжения. [45]
Страницы: 1 2 3 4