Поведение - фермент
Cтраница 1
Поведение фермента, организующего обратную связь ( в рассмотренном случае треониндезаминазы), необычайно интересно. [1]
Исследование поведения фермента как среды реакции требует, с одной стороны, экспериментального моделирования, с другой - построения теории скоростей реакций в растворах. [2]
Сходно ли поведение ферментов из тканей при высокой температуре. [3]
По предположению Кон [21] наблюдение за поведением фермента при добавлении Са2 может служить критерием для выбора схемы координации. Ферменты, образующие комплексы Е - субстрат - М2, например креатинкиназы, активируются Са2, в то время как на ферменты, образующие комплексы Е - М2 - субстрат, Са2 обычно действует как ингибитор. Основой этого эмпирического критерия является быстрая скорость обмена лигандов в Са2 - комплексах [84], поскольку для Са2 комплекс с мостико-вым металлом неустойчив. [4]
В настоящее время имеется определенная информация о поведении ферментов и белков на поверхности ртутного электрода. При адсорбции на поверхности ртути происходят существенные конформационные изменения белков. Возникающая структура содержит большое число пор, допускающих диффузию низкомолекулярных реагентов к поверхности электрода. [5]
Но Тамман одновременно обратил внимание на уточнение различий в поведении ферментов и химических катализаторов. Для этого Тамман и его сотрудники рассмотрели и доказали гидролитическую природу некоторых ферментативных процессов и показали, что ферментативный гидролиз ( в случае гликозидов и дисахаридов) идентичен классическому гидролизу, исследуемому еще со времен К. [6]
Заслуживает внимания тот факт, что в зависимости от условий поведение ферментов можно регулировать, изменяя их природные свойства или сохраняя их постоянными. [7]
Небольшое число аминогрупп пепсина и активность его ацетилированного производного позволяют легко объяснить поведение фермента. В случае других ферментов для решения вопроса о том, какой реакцией - дезаминированием или диазотированием - объясняется инактивирующее действие азотистой кислоты, приходится прибегать к кинетическим исследованиям. [8]
В задаче исследуется взаимодействие изозима II гексокиназы скелетных мышц крысы с искусственной фосфолипидной мембраной ( леци-тиновые липосомы), имитирующее поведение фермента при иммобилизации на биологической мембране. [9]
Эти данные свидетельствуют о структурной перестройке в районе активного центра лизоцима при изменении температуры в интервале 20 - 30 С и согласуются с многочисленными данными о поведении фермента в растворе. [10]
Бюхнерам, которые первыми в 1897 г. выделили препарат дрожжей путем растирания их с песком в ступке и получили сок, способный вызывать каталитическое брожение сахара с образованием спирта. Поведение ферментов, как и всех катализаторов, регулируется рядом общих правил. [11]
Мы говорили о том, что активность ферментов очень сильно зависит от кислотности среды. Чем вызвано такое поведение ферментов. Полагают, в частности, что это связано с процессами ионизации активных центров фермента под влиянием ионов Н30 и ОН - водной среды. [12]
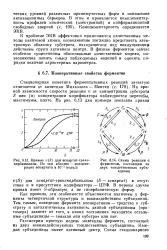 |
Кривые v ( S для аспартат-т-раис-карбамилазы. По оси абсцисс - концентрация аспартата в 10 - 3 моль / л.| Схема реакции с ферментом, состоящим из двух тождественных субъединиц. [13] |
Как правило, эти особенности объясняются наличием у фермента четвертичной структуры и взаимодействием субъединиц. Тем самым, поведение фермента кооперативно - сродство к субстрату и каталитическая активность данной субъединицы ( про-томера) зависят от того, в каких состояниях находятся остальные субъединицы - связали они субстрат или нет. [14]
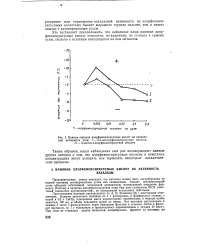 |
Кривые влияния хлорфеноксиуксусных кислот на каталаз-ную активность угля. / - 2 4-дихлорфеноксиуксусная кислота. / / - 2-метил - 4-хлорфеноксиуксусная кислота. [15] |
Страницы: 1 2