Поведение - фермент
Cтраница 2
Предварительные опыты показали, что каталаза может быть адсорбирована из водной вытяжки активированным углем или силикагелем. Однако активированный уголь обладает собственной каталазной активностью, маскирующей поведение фермента. Поэтому в качестве адсорбента-иосителя нами был взят силикагель ШСК ( шихтовый силикагель крупнопористый), не обладающий каталазным действием. [16]
Важное достижение в изучение комплексообразующих свойств макроциклических полиэфиров принадлежит Краму [175], который сформулировал концепцию химии гостя-хозяина, согласно которой молекула-хозяин образует комплекс преимущественно с веществами, гостями, путем распознавания в них определенного расположения центров связывания и стерических особенностей, комплементарных структуре молекулы-хозяина. Мотивом такого направления исследований послужило желание получить непептидные органические соединения, имитирующие поведение ферментов, особенно первую стадию ферментативного катализа, которая включает образование высокоселективного молекулярного комплекса, содержащего предпочтительную ориентацию реакционно-способных групп. Хотя ионы металлов можно расматривать как гостей, этот термин обычно используется для органических производных, обладающих более сложными стерическими требованиями и проявляющих обычно большее разнообразие возможностей связывания по сравнению с простыми ионами. [17]
Поддержание величины е в смесях на уровне их значений для водных растворов, однако, само по себе еще не обеспечивает сохранение нативной конформации многих белков, необходимой для проявления ферментативной активности. В водно-метанольных растворах, например даже в условиях, когда 8 80, наблюдается необратимое ингибирование таких ферментов, как дегидрогеназы и редуктазы. Такое поведение ферментов характерно для смесей глицерина с водой. [18]
В прошлом между химиками и биологами часто возникали разногласия по поводу интерпретации этих реакций. Благодаря напряженному труду биохимиков на протяжении последних тридцати лет тайна влияния ферментов уступила место распознанным химическим реакциями энзимов, большинство которых, а в некоторых случаях и все по своему характеру являются протеинами. Однако до полного понимания поведения ферментов in vivo еще далеко. Даже более простая задача выделения каждого из имеющих важное значение ферментов и изучение in vitro кинетики его реакции с соответствующими субстратами является весьма сложной. С одной стороны, активность ферментов, которая в молекулярном масштабе чрезвычайно высока, весьма чувствительна к температурным условиям, к рН раствора и к добавкам следов ингибиторов, по-видимому, блокирующих каталитический процесс. С другой стороны, фермент при обычных условиях реагирует через ряд связанных друг с другом и квазиравновесных реакций, включающих многие промежуточные вещества. [19]
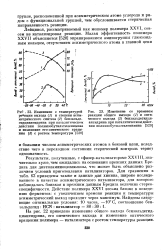 |
Изменение со временем реакции общего выхода ( 7 и оптического выхода ( 2 бензальдегидци-ангидрина при каталитическом действии полиизобутилэтиленимина. [20] |
Результаты, полученные, с фазер-катализатором XXVIII, значительно хуже, чем ожидались на основании прежних данных Бре-дига для диэтиламиноцеллюлозы, что может быть объяснено различием условий приготовления катализаторов. Для сравнения в табл. 62 приведены также и данные для хинина, широко исследованного в качестве асимметрического катализатора, для которого наблюдалась близкая к прежним данным Бредига величина стерео-специфичности. Действие полимера XXVI весьма близко к поведению ферментов: с увеличением времени реакции и температуры асимметрический выход проходит через максимум. [21]
Различные ДФФ-азы были найдены в микроорганизмах. Маун-тер и др. 160 ] исследовали 19 видов микробов и обнаружили у них огромные различия в активности - два изученных микрококка были совершенно лишены ДФФ-азного действия, тогда как наибольшей активностью обладал Proteus vulgaris. У исследованных видов найдено по меньшей мере 11 различных типов поведения фермента, отличающихся по эффектам Мп2, Со2 и Mg2; это могло быть обусловлено существованием 11 различных ферментов, или, что более вероятно, различными комбинациями меньшего числа ферментов. [22]
Несколько причин привело к этому исследованию. Во-первых, оно позволяет проводить дальнейшие эксперименты, ведущие к лучшему пониманию механизма ферментативной активности. Во-вторых, оно открывает возможности следить за влиянием температур 0 С, что невозможно осуществить в водных растворах. Поскольку in vivo ферменты, связанные с мембраной, обычно находятся в липофильном микроокружении, исследование действия ферментов в водноорганических растворителях или на матрицах с гидрофобными группами может внести вклад в выяснение поведения ферментов в их естественном окружении. Ферментативные реакции в органических растворителях могут быть также использованы для субстратов с низкой растворимостью в воде. [23]
Это различие особенно заметно при отравлении ДФФ. В то же время спонтанное восстановление активности холинэстеразы насекомых in vitro после угнетения ФОС ничтожно ( стр. Разница между восстановлением холинэстеразы in vivo и in vitro не связана с различной природой угнетенного фермента. Если холинэстеразу мух подавить in vivo, а затем гомогенизировать головы мух, то поведение фермента оказывается точно таким же, как при угнетении in vitro - фермент не восстанавливается спонтанно, он может быть реактивирован оксимами и проявляет эффект старения ( стр. [24]
Большинство белков с молекулярной массой более 20000 - 30000 обладает, однако, четвертичной структурой и состоит из нескольких индивидуальных субъединиц, которые связаны между собой за счет неко-валентных сил. Гемоглобин, например, состоит из четырех единиц, каждая из которых состоит из отдельной полипептидной цепи, а вирус табачной мозаики имеет более 2000 отдельных полипептидных цепей. Наконец, отметим, что хотя такие субъединицы из различных источников сильно варьируют по размеру, многие из них, например из гемоглобина человека, соответствуют примерно размеру субъединицы в 17600 ( полипептидная цепь из 150 аминокислотных остатков), как это впервые предположил Сведберг [10], и они подчиняются сведберговскому закону кратности. Объединение таких белковых субъединиц с воссозданием полностью активного биологического комплекса обычно называют четвертичной структурой белка. Изучение взаимодействия субъединиц является чрезвычайно важным аспектом современной молекулярной биологии, так как эти взаимодействия несомненно играют важную роль во многих биологических реакциях. Современными классическими примерами влияния таких свойств на биологические явления слу - - жат аллостерическое поведение ферментов и кооперативность связывания кислорода в гемоглобине. Тетрамерная структура гемоглобина содержит четыре участка, связывающих кислород, и эта структура такова, что когда один из участков связывает кислород, то небольшие изменения в конформации полипептидной цепи вокруг этого участка передаются на следующий участок с тем, чтобы увеличить его сродство к кислороду. Как только произойдет связывание кислорода каждым из первых трех участков, аналогичный эффект наблюдается на следующем участке. Такое поведение чрезвычайно важно для характеристики гемоглобина как переносчика кислорода. [25]
Страницы: 1 2