Поведение - электрод
Cтраница 1
Поведение электродов с промежуточными значениями потенциалов определяется по отношению их начальных потенциалов к общему потенциалу, приобретаемому всей системой. Нахождение общего потенциала сложной системы сводится к построению суммарной поляризационной кривой в координатах потенциал - сила тока по известным поляризационным характеристикам, соотношению поверхностей и омическим сопротивлениям в цепи каждого электрода. [1]
Поведение электродов из алюминия, кальция и магния в органических электролитах изучено в меньшей степени, чем поведение лития. Практические устройства, в которых эти металлы использовались бы в источниках тока с органическими электролитами, неизвестны. [2]
Поведение электрода в нейтральных и щелочных растворах более удовлетворительно объясняется теорией твердофазного восстановления двуокиси марганца. [3]
Рассмотрим поведение электрода, на котором протекает процесс, включающий медленную химическую стадию, в переменном токе. Концентрация вещества на поверхности периодически отклоняется от своего равновесного значения. Если амплитуда переменного тока невелика, то эти отклонения также будут невелики. [4]
Рассмотрим поведение электрода сначала при небольшой поляризации. [5]
Такое поведение электрода следует рассматривать как результат взаимного наложения электродных функций натрий-селективного электрода по ионам водорода и серебра; потенциал поддерживается на постоянном уровне, пока концентрация ионов водорода постоянна, и скачкообразно меняется при появлении избытка ионов серебра в точке эквивалентности. [6]
За поведением электродов, разрушающихся во время окисления, невозможно наблюдать при использовании искровых разрядов с малой постоянной времени. [7]
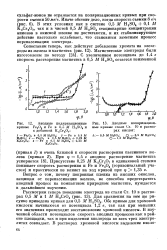 |
Анодные поляризационные кривые стали Ст. 10 в растворах кислот. [8] |
Рассмотрим теперь поведение электрода из стали Ст. Обе кривые для хромовой кислоты начинаются от потенциала 1 2 в, так как при меньших его значениях происходит восстановление хромовой кислоты. В изученной области потенциалов скорость анодных процессов как в районе площадки, так и при выделении кислорода во всех трех электролитах совпадает. [9]
Подробно изучено поведение электродов из металлов платиновой группы ( Pt, Pd, Rh, Ir, Os, Ru) и их сплавов ( Pt - Pd, Pt - Ru, Pd - Ru) в кислых и ще - лочных растворах метанола. Рассмотрена природа потенциалов, возникающих при введении электрода в контакт с растворами метанола, а также природа и свойства веществ, хемосорбированных из раствора. В растворах органических веществ на поверхности исследуемых металлов прочно хемосорбированы продукты распада органических молекул. Отмечено различие между механизмом процесса окисления метанола на свободной или незначительно покрытой хемосорбирован-ным веществом поверхности и механизмом электроокисления в стационарных условиях. Рассмотрены некоторые особенности поведения электродов из платиновых металлов в растворах формальдегида и муравьиной кислоты. Подробно изучены природа потенциалов, возникающих в растворах метана, закономерности адсорбции и механизм электрохимического окисления метана. Полученные данные по электроокислению метана на платине объясняются при предположении о замедленности дегидрирования метана на поверхности электрода. [10]
 |
Схема установления стационарного коррозионного потенциала t. KOV при сравнимых скоростях катодной и анодной реакции. [11] |
Следовательно, поведение корродирующего электрода отвечает поведению обратимого металлического электрода, а установившееся значение компромиссного потенциала близко к равновесному потенциалу соответствующего металлического электрода ( рис. 24.2) и должно изменяться с концентрацией ионов металла в соответствии с формулой Нернста. [12]
 |
Схема установления стационарного коррозионного потенциала е. кор при сравнимых скоростях катодной и анодной реакции. [13] |
Следовательно, поведение корродирующего электрода отвечает поведению обратимого металлического электрода, а установившееся значение компромиссного потенциала близко к равновесному потенциалу соответствующего металлического электрода ( рис. 24.2) и должно изменяться с концентрацией ионов металла в соответствии с формулой Нернста. Изменение рН раствора не влияет при этом заметно на величину стационарного потенциала. [14]
Нами было исследовано поведение электродов из армко-железа в 2 Л H2S04 при саморастворении и при внешних катодных поляризациях. Кривая 1 снималась вскоре после погружения электрода в раствор, 2 - через сутки, 3 - через двое суток после начала саморастворения образца. Параллельное смещение в сторону положительных потенциалов катодных поляризационных кривых, аналогичное приведенному на рис. 7, наблюдалось нами и на других железных электродах. Из рис. 7 видно, что соответствующие стационарному потенциалу р - 242 мв скорости саморастворения железа г 0, отнесенные, как и плотности тока, к 1 с. [15]
Страницы: 1 2 3 4