Поведение - сильный электролит
Cтраница 2
Полученное Фалькенгагеном и Кельбгом уравнение хоро шо описывает поведение сильных электролитов до концентраций значительно более высоких, чем уравнения Дебая. [16]
Оказалось, что электростатическое взаимодействие не является единственной причиной, обусловливающей поведение сильных электролитов в растворах. [17]
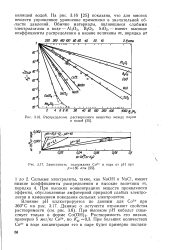 |
Распределение растворенного вещества между паром.| Зависимость содержания Со2 1 в паре от рН при / 7185 атм. [18] |
При высоких концентрациях веществ проявляются эффекты, обусловленные амфотерной природой слабых электролитов и изменением поведения сильных электролитов. [19]
Хюккелем ( 1923), позволила объяснить противоречивые, на первый взгляд, данные о поведении сильных электролитов, а также создала основу для количественных расчетов характеристик сильных электролитов. [20]
Конечно, и в этих растворителях слабые электролиты не подчиняются приведенным зависимостям. Не подчиняется им и поведение сильных электролитов в концентрированных растворах. [21]
Конечно и в этих растворителях слабые электролиты не подчиняются этим зависимостям. Не подчиняется им и поведение сильных электролитов в концентрированных растворах. [22]
Конечно, и в этих растворителях слабые электролиты не подчиняются приведенным зависимостям. Не подчиняется им и поведение сильных электролитов в концентрированных растворах. [23]
К счастью, выводы теории междуионного притяжения могут быть про-1 верены непосредственно, так как существует класс сильных электролитов, которые при умеренных концентрациях в водных растворах, повидимому, полностью диссоциированы и растворы которых соответствуют нрортой электростатической схеме заряженных ионов, находящихся в среде с данной диэлектрической постоянной. Уже давно были высказаны предположения, что поведение сильных электролитов в разбавленных растворах можно объяснить на основании гипотезы полной диссоциации и соответствующего учета влияния междуиотюго притяжения. [24]
Ганч высказали точку зрения, согласно которой отклонения в поведении сильных электролитов объясняются их полной диссоциацией. В настоящее время эта точка зрения является общепризнанной. [25]
Уравнение закона действия масс (2.68) справедливо лишь для разбавленных растворов слабых электролитов. При применении его к концентрированным растворам и к растворам сильных электролитов необходимо учитывать особенности поведения сильных электролитов в растворе, а также веществ в концентрированных растворах, обусловленные различного рода взаимодействиями частиц растворенного вещества друг с другом и с растворителем. [26]
К этому следует добавить, что отгораживание свойств электролитов от неэлектролитов, свойств сильных электролитов от слабых электролитов также не приводит к совершенной теории растворов. Вероятно, затруднения, которые испытывает теория электролитов сейчас, являются результатом недооценки того, что характер поведения сильных электролитов мало отличается от характера поведения слабых электролитов, что поведение тех и других подчиняется общим законам, что сильные и слабые электролиты - только предельные случаи диссоциации веществ на ионы. [27]
К этому следует добавить, что разграничение свойств электролитов и неэлектролитов, свойств сильных электролитов и слабых электролитов также не приводит к совершенной теории растворов. Вероятно, затруднения, которые испытывает теория электролитов сейчас, являются результатом недооценки того, что характер поведения сильных электролитов мало отличается от характера поведения слабых электролитов, что поведение тех и других подчиняется общим законам, что сильные и слабые электролиты-только предельные случаи диссоциации веществ на ионы. [28]
Данная глава посвящена кинетическим исследованиям растворов ПАВ, образующих мицеллы. При очень низких концентрациях ПАВ ( 10 - 4 - 10 - 2 моль / дм3) поведение ПАВ ионного типа в водном растворе напоминает поведение сильных электролитов, а свойства неионных ПАВ подобны свойствам простых органических веществ. Однако при повышении концентрации ПАВ наблюдаются значительные отклонения от таких идеальных свойств. На рис. 3.2 приведен типичный график наблюдаемого изменения эквивалентной электропроводности в зависимости от концентрации ПАВ. [29]
В настоящее время отступление сильных электролитов от классической формы закона действия масс может быть объяснено при помощи теории сильных электролитов, предложенной Дебаем и Гюккелем. Основная идея этой теории заключается в том, что между ионами, образующимися при электролитической диссоциации сильных электролитов, возникают силы взаимного притяжения. Эти межионные силы вызывают отклонение поведения сильных электролитов от законов идеальных растворов. [30]
Страницы: 1 2 3