Кинетическое поведение - система
Cтраница 1
Кинетическое поведение систем, содержащих и не содержащих фосфатную группу, совершенно различно. Аналоги ФМН ( рибофлавин и его производные), отличающиеся от ФМН отсутствием фосфатной группы ( табл. 31), комллексу-ются апоферментом по одностадийному механизму. [1]
Рассмотрите кинетическое поведение системы для следующего простейшего случая ошибочной ориентации субстрата в активном центре фермента: фермент Е катализирует односубстратную реакцию, в которой нормальный субстрат PQ связывается на ферменте в центре Р, что позволяет осуществить перенос группы Q к центру Q фермента. Самопроизвольное отщепление Q от Q регенерирует свободный фермент. Поскольку Р имеет сродство лишь с Р, ошибочная ориентация исключается. Если же субстрат имеет строение. Хотя группировка R имеет то же сродство к Р, как и Р, она способна связываться отчасти и с Q, в результате чего RQ иногда образует с ферментом комплекс с обратной ориентацией, не способный к расщеплению. В обоих случаях субстрат связывается с ферментом обратимо, причем в каждый момент времени одна молекула фермента может связывать лишь одну молекулу субстрата. [2]
Найденные особенности кинетического поведения системы могут быть представлены на основе вида зависимости У ( щ, S) синергетичес-кого потенциала от величин if, S, параметризующих поведение системы. Как видно из рис. 9 о, в него система быстро скатывается вдоль оси 5, отвечающей большей кривизне. [3]
Каждому формальному механизму реакции соответствует определенное кинетическое поведение системы. Вывод кинетических уравнении, количественно описывающих это поведение, позволяет сопоставить постулированный механизм исследуемой реакции с экспериментальными данными. [4]
Экспериментальными исследованиями была установлена контролируемость кинетического поведения систем ПАА - АК и ПАА - МАК. Показано, что образующиеся при этом полимеры обладают ограниченной набухаемостью в водной среде и усадкой в углеводородной среде. [5]
Согласно фазовым портретам, показанным на рис. 6, универсальность кинетического поведения системы проявляется как при ТА т, так и при т /, тч. В отличие от ранее рассмотренных случаев универсальный участок фазовых траекторий имеет не спадающий, а нарастающий характер. [6]
Из сказанного выше следует, что любой параметр, не влияющий на константу равновесия, но оказывающий влияние на кинетическое поведение системы, должен одинаково сказываться на константах скорости прямой и обратной реакций. Это относится, в частности, к катализу. Катализатор ускоряет прямую реакцию точно во столько же раз, во сколько и обратную реакцию. [7]
Хроматографическое изучение изменения концентрации исходных соединений и продуктов реакции во времени позволяет получить в большинстве случаев необходимую информацию для описания кинетического поведения системы. [8]
Таким образом, были получены новые экспериментальные данные по скорости диффузии в газах при высоких давлениях, обнаружены новые интересные факты, связанные с влиянием критической точки на кинетическое поведение систем, а именно: невозможность даже формального применения закона Фика, факт неизбежного сопровождения молекулярной диффузии конвективным перемещением всей массы газа и, наконец, резкое замедление диффузии вблизи критической точки равновесия жидкость - пар. [9]
Распространение идей термодинамики на неравновесные динамические системы связано, кроме решения задач о нахождении возможных стационарных состояний, с решением основной проблемы: можно ли, зная особенности кинетического поведения системы реакций, из термодинамических соображений предсказать устойчивость стационарного состояния или, наоборот, возможность самопроизвольного перехода в другой стационарный режим при небольших возмущениях, или же найти условия устано & 1ения устойчивого колебательного режима. Особенно важным здесь является то обстоятельство, что термодинамический подход позволяет дать ответы на эти и некоторые другие вопросы даже в условиях ограниченных или далеко не полных знаний относительно реальной кинетической схемы анализируемого динамического процесса. [10]
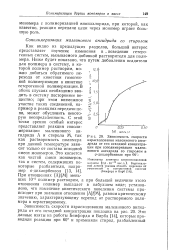 |
Зависимость скорости израсходования малеинового ангидрида от его исходной концентрации при сополимеризации малеинового ангидрида со стиролом в 0-дихлорбензоле при 60. [11] |
При отношениях [ А ] / [ М ] меньших 10 - 2 полимер растворим, а при большей величине этого отношения полимер выпадает в набухшем виде; установлено, что изменение кинетического поведения системы происходит при значении отношения [ А ] / [ М ], равном критическому значению, характеризующему переход от растворимого полимера к нерастворимому. [12]
Динамика конформационных изменений, сопровождающих комплексообразование белков с лигандами, в ряде случаев детально исследована методом температурного скачка. Рассмотрим кинетическое поведение системы, описываемой схемой (9.11) в условиях, близких к равновесию. [13]
Особый случай реакции в массе представляет совместная полимеризация малеинового ангидрида и стирола [13, 14], так как при этом система может быть гомогенной или гетерогенной в зависимости от молярного соотношения между количествами реагентов. Последнее и определяет кинетическое поведение системы. [14]
При этих условиях вопрос о том, какая реакция - роста или обрыва - - больше замедляется окклюзией, решается в зависимости от относительных скоростей диффузии мономера и хлорного железа внутрь агрегатов. Резкое различие между кривыми А и В указывает на большое значение природы реакции обрыва при определении кинетического поведения системы в гетерогенных условиях. [15]
Страницы: 1 2