Электрохимическое поведение
Cтраница 1
Электрохимическое поведение, кинетика окисления ртути ( I) и восстановления ртути ( II) хорошо изучены. Установлены оптимальные значения Ер. [1]
Электрохимическое поведение гафния в основном подобно поведению циркония. [2]
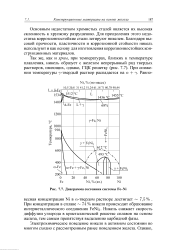 |
Диаграмма состояния системы Fe - Ni. [3] |
Электрохимическое поведение никеля в активном состоянии во многом сходно с рассмотренным ранее поведением железа. [4]
Электрохимическое поведение полония в этих растворах совершенно различно. Значение Етл для свежеприготовленного раствора равно 0.61 0.01 V, что говорит о том, что весь полоний находится в четырехвалентном состоянии. [6]
Электрохимическое поведение индия при анодном растворении из стационарной капли амальгамы в методе амальгамной полярографии с накоплением изучено в работе Захаровой и Килиной [ 1, с. [7]
Электрохимическое поведение селена ( IV) и теллура ( IV) на ртутных капающем и стационарном электродах [1-18] изучалось достаточно широко. Полярографическое определение этих элементов имеет преимущества перед другими физико-химическими методами по чувствительности и разрешающей способности. [8]
Электрохимическое поведение никеля в активном состоянии во многом сходно с поведением железа. В тех же условиях галогенид-ионы, присутствующие даже в небольших количествах, тормозят процесс, что можно связать с адсорбционным вытеснением ими ионов ОН 1 [ 36J, Скорость. [9]
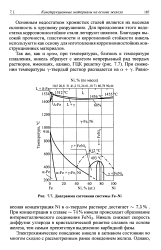 |
Диаграмма состояния системы Fe-Ni. [10] |
Электрохимическое поведение никеля в активном состоянии во многом сходно с рассмотренным ранее поведением железа. [11]
Электрохимическое поведение элемента, выделяемого методом электроосаждения, определяется, в первую очередь, величиной его электродного потенциала. Выше было показано, что электродные потенциалы элементов, находящихся в растворах в микроконцентрациях, значительно отличаются от электродных потенциалов тех же элементов в макроконцентрациях. [12]
Электрохимическое поведение хинонов в апротониых средах рассмотрено в монографии [63] - Как можно было бы ожидать на основании вышеизложенного, восстановление хинонов. [13]
Электрохимическое поведение лития замечательно во многих отношениях, и некоторые из них рассмотрены ниже. Таким образом, кажется вполне вероятным, что литий является более электроотрицательным или менее благородным металлом, чем другие щелочные металлы. Однако если принять во внимание гидратацию ионов щелочных металлов, то станет ясно, что это не так. Все ионы щелочных металлов в водном растворе в большей или меньшей степени гидрати-рованы, причем ион лития гидратирован гораздо сильнее, чем, например, ион цезия. Этим объясняется, почему подвижность небольшого иона лития приблизительно только вдвое меньше, чем подвижность гораздо большего нона цезия. На явную склонность иона лития присоединять молекулы воды указывает то, что при его гидратации выделяется большое количество тепла. [14]
Электрохимическое поведение элемента, выделяемого методом электроосаждения, определяется, в первую очередь, величиной его электродного потенциала. Выше было показано, что электродные потенциалы элементов, находящихся в растворах в микроконцентрациях, значительно отличаются от электродных потенциалов тех же элементов в макроконцентрациях. Например, потенциалы Bi3 и Ро5 при концентрации 1СГ6 н равны соответственно 0 04 и 0 656 В. В то же время потенциал РЬ2 при такой же концентрации отрицателен и составляет - 0 25 В. Поэтому эти элементы, присутствующие совместно в продуктах радиоактивного распада радия, можно эффективно разделить электролизом. [15]
Страницы: 1 2 3 4