Электрохимическое поведение
Cтраница 2
Электрохимическое поведение бериллия в неводных средах изучено весьма поверхностно. По полярографическим данным для обоих металлов характерно наложение на реакцию переноса заряда мешающего влияния адсорбции, и химических реакций. [16]
Электрохимическое поведение элемента, выделяемого методом электроосаждения, определяется, в первую очередь, величиной его электродного потенциала. Выше было показано, что электродные потенциалы элементов, находящихся в растворах в микроконцентрациях, значительно отличаются от электродных потенциалов тех же элементов в макроконцентрациях. Например, потенциалы Bi3 и Ро5 при концентрации 1СГ6 н равны соответственно 0 04 и 0 656 В. В то же время потенциал РЬ2 при такой же концентрации отрицателен и составляет - 0 25 В. Поэтому эти элементы, присутствующие совместно в продуктах радиоактивного распада радия, можно эффективно разделить электролизом. [17]
Электрохимическое поведение бериллия в неводных средах изучено весьма поверхностно. По полярографическим данным для обоих металлов характерно наложение на реакцию переноса заряда мешающего влияния адсорбции, и химических реакций. [18]
Электрохимическое поведение биполярного электрода отличается своеобразием. При включении тока одна сторона электрода становится катодной и на ней протекает реакция восстановления молекул воды до водорода, другая сторона - анодной и на ней образуется кислород. Таким образом, суммарный скачок потенциала между приэлектродными слоями электролита составляет разность потенциалов анода и катода и может достигать 2 3 В и выше. При этом падение напряжения в, самом электроде остается ничтожно малым. [19]
Электрохимическое поведение металлоорганических соединений вот уже около 70 лет привлекает к себе неослабное внимание. [20]
Электрохимическое поведение исследуемых сталей мало отличается одно от другого. Однако с ростом температуры ( 80 - 90 С) стационарный потенциал изменяется до - 0 5 В, а сталь подвергается значительной коррозии. Стационарный потенциал стали 10Х17Н13М2Т находится в области устойчивого пассивного состояния ( 0 1 В) при температурах до 50 С. Выше этой температуры происходит активация стали до потенциалов - 0 7 В, что соответствует области активного растворения ее. Хромоникелевая сталь 12Х18Н10Т наименее устойчива в стационарных условиях. [21]
Электрохимическое поведение металлических сплавов при анодной поляризации определяется парциальными характеристиками компонентов, их содержанием в сплаве. При создании новых коррозион-ностойких аморфных сплавов необходимо учитывать также возможное влияние структуры материала и состояние его поверхности. [22]
Электрохимическое поведение ионов нептуния на платиновом электроде в водных средах хорошо изучено. Показано, что сочетанием различных способов восстановления и окисления можно установить содержание ионов нептуния, присутствующих в растворе в нескольких степенях окисления. [23]
Электрохимическое поведение жидкокристаллических ьеществ близко соответствует общей схеме поведения органических соединений с кратными связями. [24]
Электрохимическое поведение органических соединений обладает рядом характерных особенностей. [25]
Электрохимическое поведение биполярного электрода отличается своеобразием. При включении тока одна сторона электрода становится катодной и на ней протекает реакция восстановления молекул воды до водорода, другая сторона - анодной и на ней образуется кислород. Таким образом, суммарный скачок потенциала между приэлектродными слоями электролита составляет разность потенциалов анода и катода и может достигать 2 3 В и выше. При этом падение напряжения в самом электроде остается ничтожно малым. [26]
Электрохимическое поведение платинового электрода довольно подробно изучалось во многих работах, и поэтому его можно сравнить с адсорбционным поведением, изученным недостаточно. [27]
Электрохимическое поведение биполярного электрода отличается своеобразием. При включении тока одна сторона электрода становится катодной и на ней протекает реакция восстановлении молекул воды до водорода, другая сторона - анодной и на ней образуется кислород. Таким образом, суммарный скачок потенциала между приэлектродными слоями электролита составляет разность потенциалов анода и катода и может достигать 2 3 Б и выше. При этом падение напряжения в самом электроде остается ничтожно малым. [28]
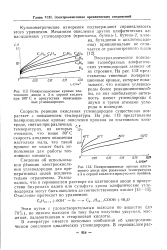 |
Поляризационные кривые платинового анода в 3 н. серной кислоте при 100 С в присутствии ненасыщенных углеводородов. [29] |
Электрохимическое поведение газообразных алифатических углеводородов зависит от их строения. На рис. 112 представлены типичные поляризационные кривые, которые показывают, что низшие углеводороды более реакционноспособ-ны, из них наибольшую активность имеют углеводороды с двумя и тремя атомами углерода в молекуле. [30]
Страницы: 1 2 3 4