Электрохимическое поведение - металл
Cтраница 1
 |
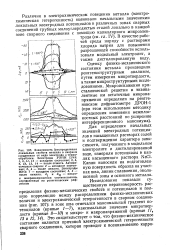
Электрическая схема для изучения работы макроэлементов в зазорах и распределения поляризующего тока по. [1] |
Электрохимическое поведение металлов в зазорах можно в некоторых случаях изучать, создавая зазоры с помощью плексигласовой накладки. Например, измерять необратимые электродные потенциалы металла в зазорах можно обычным потенциометрическим методом и в условиях, когда исследуемый образец находится в накладке. Электрический контакт с образцом осуществляется посредством металлического стержня, ввинченного в образец и изолированного от воздействия коррозионной среды инертным лаком. Однако для поляризационных измерений необходим уже более совершенный прибор. [2]
Электрохимическое поведение металлов платиновой группы характеризуется рядом особенностей. Эти металлы необратимы по отношению к собственным ионам в растворе и потенциал их определяется концентрацией водородных ионов. [3]
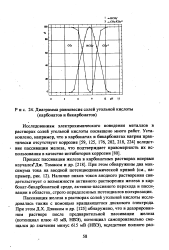 |
Диаграмма равновесия солей угольной кислоты ( карбонатов и бикарбонатов. [4] |
Исследованиям электрохимического поведения металлов в растворах солей угольной кислоты посвящено много работ. [5]
Исследованиям электрохимического поведения металлов в раст-во ах солей угольной кислот 1 посвящено много работ. Установлено, например, что в карбонатах и бикарбонатах натрия наблюдаются кулевые скорости коррозии вследствие самопассивации железа, что подтверждает правомерность их использования в качестве ингибиторов коррозии. [6]
Различия в электрохимическом поведении металла ( электрохимическая гетерогенность) оценивали начальными значениями локальных электродных потенциалов в различных зонах сварных соединений трубных малоуглеродистых сталей локально в каждой зоне сварного соединения с помощью капиллярного микроэлектрода ( см. гл. [8]
Сведения об электрохимическом поведении металлов подгруппы ванадия немногочисленны. Большинство исследований посвящена выяснению возможности выделения их из органических растворителей и носит качественный характер. Полярографи-рование растворов NbCl5 в некоторых органических растворителях [893, 1030] приводит к полярограмме с одной волной. Возможно, ее появление, как и в водных растворах [476], связано с образованием низшей степени окисления ниобия и каталитическим химическим процессом. Установлена зависимость высоты этих волн от концентрации ниобия и возможность использования их для аналитических целей. Как и следовало ожидать, величина константы скорости значительно ниже, чем в воде. [9]
Сведения об электрохимическом поведении металлов подгруппы ванадия немногочисленны. Большинство исследований посвящена выяснению возможности выделения их из органических растворителей и носит качественный характер. Полярографи-рование растворов NbCls в некоторых органических растворителях [893, 1030] приводит к полярограмме с одной волной. Возможно, ее появление, как и в водных растворах [476], связано с образованием низшей степени окисления ниобия и каталитическим химическим процессом. Установлена зависимость высоты этих волн от концентрации ниобия и возможность использования их для аналитических целей. Как и следовало ожидать, величина константы скорости значительно ниже, чем в воде. [10]
Общеизвестно, что электрохимическое поведение металлов определяется величиной их электродных потенциалов. При электролизе растворов, содержащих различные ионы, на катоде в первую очередь происходит разряд тех ионов, которые характеризуются наиболее положительным потенциалом; на аноде же в первую очередь происходит разряд ионов, характеризующихся наименее, положительным потенциалом. Известно также, что в процессе электролиза потенциал электрода не соответствует величине равновесного потенциала, определяемого формулой Нернста, а сдвигается при катодном процессе в сторону электроотрицательных значений, при анодном - в сторону электроположительных. Происходит так называемая поляризация электродов, которая проявляется тем сильнее, чем больше плотность тока на электродах. [11]
 |
Анодные поляризационные кривые гладкой платины в 1 н. H2SO4, снятые со скоростью смещения потенциала. [12] |
Рассмотренная выше зависимость электрохимического поведения металлов от большого числа разнообразных факторов требует от исследователя тщательного продумывания и подготовки методики, аккуратного проведения опытов. [13]
С современных позиций рассмотрено электрохимическое поведение металлов под адсорбционными и фазовыми слоями электролитов. Приведено большое количество экспериментальных данных о влиянии внешних условий на развитие коррозии металлов. На основе физико-математических моделей рассмотрена возможность использования ускоренных лабораторных испытаний для прогнозирования коррозионного поведения металлов в различных климатических зонах. Дана оценка эффективности современных средств и методов защиты металлов от коррозии. [14]
Весь экспериментальный материал по электрохимическому поведению металлов в тонких слоях, изложенный ниже, позволяет сделать вывод, что с утонынением слоя электролита на поверхности металла кинетика обеих электродных реакций, обусловливающих коррозионный процесс, изменяется не в одинаковом направлении; катодная реакция, заключающаяся в восстановлении кислорода, всегда ускоряется, анодная же ионизация металла чаще всего замедляется. Некоторые металлы ( железо, цинк) подвергаются слабой анодной поляризации как в объеме электролита, так и в тонких слоях. [15]
Страницы: 1 2 3 4