Поверхность - полярный адсорбент
Cтраница 1
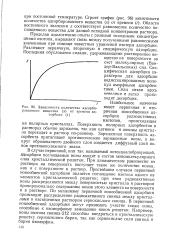 |
Зависимость количества адсорбированного вещества ( х от времени адсорбции ( t. [1] |
Поверхность полярных адсорбентов в растворах обычно заряжена, так как катионы и анионы кристалла переходят в раствор по-разному. Заряженная поверхность адсорбента притягивает противоположно заряженные ионы, а вокруг образованного двойного слоя создается диффузный слой ионов противоположного знака. [2]
В отличие от поверхности полярных адсорбентов, образованной ионами, поверхность активного угля образована электронейтральными ( ковалентная связь) атомами углерода и почти лишена электрически заряженных центров, аполярна. Вследствие этого электростатические силы имеют при адсорбции на угле второстепенное, очень малое значение Основными же адсорбционными силами являются силы дисперсионные, наиболее слабые из прочих сил молекулярного взаимодействия. Этим объясняются многие свойства активных углей. [3]
Знак заряда ( или -) поверхности твердого полярного адсорбента может иметь первичное происхождение, зависящее непосредственно от природы поверхности адсорбента. [4]
При адсорбции сильных электролитов из раствора на поверхности полярных адсорбентов адсорбция редко носит молекулярный характер, когда анион и катион адсорбируются в эквивалентных количествах. Обычно, в зависимости от природы адсорбента или адсорбируемых ионов, адсорбируются преимущественно анионы или катионы. На границе раздела раствор - полярная твердая фаза возникает двойной электрический слой, как результат преимущественной адсорбции одного из ионов или диссоциации полярных групп. Ионы внешней обкладки этого слоя, сравнительно слабо связанные с твердой фазой силами электростатического взаимодействия, могут обмениваться о одноименными ионами из раствора в эквивалентных количествах. [5]
В работах [3, 332] показано, что уже при малых концентрациях полярного элюента в таких системах на поверхности полярного адсорбента образуется адсорбированный монослой молекул полярного компонента - элюента. В этом случае удерживание веществ сильно ослабляется. Молекулы разделяемых веществ должны вытеснять полярные молекулы элюента с поверхности адсорбента ( на это затрачивается энергия) или же адсорбироваться на прочно удерживаемом адсорбентом монослое этих полярных молекул. Обе эти причины приводят к уменьшению удерживания. [7]
В случае же адсорбции на полярном адсорбенте из неполярного растворителя попадание в элюент влаги из воздуха из-за ее адсорбции на поверхности полярного адсорбента может сильно повлиять на величины К. [8]
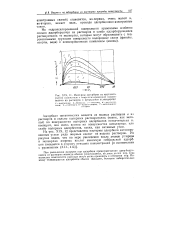 |
Изотермы адсорбции на крупнопористом силикагеле с гидроксилированной поверхностью из растворов в предельном углеводороде. [9] |
Адсорбция органических веществ из водных растворов и из растворов в сильно полярных растворителях ( таких, как метанол) на поверхностях полярных адсорбентов незначительна и, наоборот, она очень велика на поверхностях неполярных или слабо полярных адсорбентов, таких, как активные угли. [10]
 |
Изотерма адсорбции додецилсульфата натрия. из 0 1 М раствора NaCl при рМ 6 5 на оксиде алюминия ( удельная поверхнбсть 15 Ю3 ма / кг. [11] |
Вид изотермы адсорбции ИПАВ на полярной поверхности оксидов металлов и оксида кремния определяется не только особенностями строения адсорбирующихся ионов, но также структурой и зарядом поверхности полярных адсорбентов, который в большой мере зависит от рН, поскольку ионы Н и ОН - являются для этих адсорбентов потенциалообразующими. [12]
 |
Изотерма адсорбции додецилсульфата натрия из М раствора NaCI при рН 6 5 на оксиде алюминия ( удельная поверхность 15 - Ю3 м2 / кг. [13] |
Вид изотермы адсорбции ИПАВ на полярной поверхности оксидов металлов и оксида кремния определяется не только особенностями строения адсорбирующихся ионов, но также структурой и зарядом поверхности полярных адсорбентов, который в большой мере зависит от рН, поскольку ионы Н и ОН являются для этих адсорбентов потенциалообразующими. [14]
Поверхность полярных адсорбентов в растворах электролитов обладает электрическим зарядом, возникающим в результате поверхностной диссоциации ионогешых групп адсорбента или избирательной адсорбции. Влияние заряженной поверхности на ионную адоорбцию определяется вторым правилом Пескова-Фаянса: на твердой поверхности адсорбируется тот ион, знак которого противоположен по знаку поверхности и который может образовывать о одним из ионов решетки мало растворимое соединение. [15]
Страницы: 1 2
