Заряженная поверхность - металл
Cтраница 2
В теории Фольмера двойной электрический слой представляется в виде плоского конденсатора. В таком случае учитываются только электрические силы, действующие между заряженной поверхностью металла и ионами раствора. При этом количество ионов, находящихся во внешней обкладке двойного слоя, точно соответствует числу противоположных по знаку зарядов на электроде; эти ионы расположены вдоль поверхности, вплотную к ней. [16]
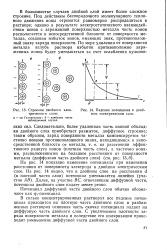 |
Строение двойного элек - [ IMAGE ] Падение потенциала в двой-трического слоя. ном электрическом слое. [17] |
В большинстве случаев двойной слой имеет более сложное строение. Под действием беспорядочного молекулярного теплового движения ионы стремятся равномерно распределиться в растворе; однако в результате электростатического взаимодействия ионов с заряженной поверхностью металла часть ионов располагается в непосредственной близости от поверхности металла, создавая избыток ионов, имеющих знак, противоположный знаку заряда поверхности. [18]
Хемосорбция ингибиторов существенно зависит и от природы металла. Например, гетероциклические амины, адсорбируясь на железе, являющемся переходным металлом, образуют прочные хемосорбционные пленки благодаря взаимодействию тг-электронов молекулы ингибитора с незавершенными Sd-уровнями железа. В непереходных металлах такого взаимодействия не происходит, хотя положительно заряженная поверхность металлов в некоторой мере может ассимилировать, например, тг-электроны и создавать тем самым специфическую адсорбцию дополнительно к электростатической. [19]
Из этих величин р - потенциалов следует, что в условиях электроосаждения никель имеет наиболее отрицательный заряд, за ним следует цинк, который также заряжен отрицательно, в то время как кадмий и свинец заряжены положительно. В ходе электровыделения на поверхности осадков никеля и цинка должны адсорбироваться преимущественно катионы, а на поверхности осадков кадмия и свинца главным образом анионы. Эти выводы справедливы лишь для растворов, в которых нет поверхностноактивных ионов, способных адсорбироваться и на одноименно заряженной поверхности металла. Однако их удается распространить и на растворы, содержащие поверхностноактивные вещества, если специфика адсорбции обусловлена особенностью их частиц, а не свойствами металла. Тогда, зная, как протекает адсорбция поверхностноактивных веществ хотя бы на одном из металлов, например на ртути, можно, используя приведенную шкалу, найти наиболее вероятную область потенциалов, в которой следует ожидать адсорбцию тех же самых веществ на поверхности любого другого металла. Это позволяет установить в каждом конкретном случае возможности их влияния на кинетику электроосаждения. Принимая как первое приближение, что десорбция всегда начинается при одном и том же заряде и используя свойства ф-шкалы, можно утверждать, что для любого металла М она будет проходить при мфдео, равном н фдес. [20]
Из этих величин ф-потенциалов следует, что в условиях электроосаждения никель имеет наиболее отрицательный заряд, за ним следует цинк, который также заряжен отрицательно, в то время как кадмий и свинец заряжены положительно. В ходе электровыделения на поверхности осадков никеля и цинка должны адсорбироваться преимущественно катионы, а на поверхности осадков-кадмия и свинца главным образом анионы. Эти выводы справедливы лишь для растворов, в которых нет поверхностно-активных ионов, способных адсорбироваться и на одноименно заряженной поверхности металла. Однако их можно распространить и на растворы, содержащие поверхностно-активные вещества, если только специфика адсорбции обусловлена особенностью их частиц, а не свойствами металла. Тогда, зная, как протекает адсорбция поверхностно-активных веществ хотя бы на одном из металлов, например на ртути, можно, используя приведенную шкалу, найти наиболее вероятную область потенциалов, в которой можно ожидать адсорбцию тех же самых веществ на поверхности любого другого металла. [21]
Из этих величин ф-потенциалов следует, что в условиях электроосаждения никель имеет наиболее отрицательный заряд, за ним следует цинк, который также заряжен отрицательно, в то время как кадмий и свинец заряжены положительно. В ходе электровы - деления на поверхности осадков никеля и цинка должны адсорбироваться преимущественно катионы, а на поверхности осадков кадмия и свинца-главным образом анионы. Эти выводы, строго говоря, справедливы лишь для растворов, в которых нет поверхностно-активных ионов, способных адсорбироваться и на одноименно заряженной поверхности металла. [22]
Поясним, как образуется ряд стандартных электродных потенциалов. Погружение металла в раствор одноименной соли приводит к процессам перехода ионов металла с поверхности металла в раствор - растворение металла, или из раствора в металл - осаждение металла. Вследствие этих процессов поверхность металла ( электрода) приобретает положительный или отрицательный заряд, причем его величина и знак будут определяться природой металла, концентрацией соли в растворе и температурой. Гидратированные катионы и анионы, находящиеся в растворе, притягиваются заряженными поверхностями металлов, в результате чего на поверхности раздела металл-раствор образуется два слоя с противоположными зарядами - так называемый двойной электрический слой. Разность потенциалов этого слоя носит название электродного потенциала. [23]
Между тем аналогия здесь чисто внешняя. В то время как в присутствии алифатических соединений оба максимума на С, ф-кривых связаны с процессами адсорбции-десорбции, в случае пиридина и анилина этим процессам отвечают только катодные максимумы. Анодные же максимумы связаны с процессами переориентации адсорбированных молекул органического вещества на поверхности ртути: вертикальное расположение молекул пиридина и анилина, характерное для отрицательно заряженной поверхности, сменяется плоским расположением, при котором л-электроны пиридинового или бензольного кольца вступают во взаимодействие с положительными зарядами поверхности ртути. Приблизительное совпадение емкости двойного слоя в растворе фона и в присутствии органического вещества в области больших положительных зарядов поверхности может быть объяснено тем, что л-электроны бензольного или пиридинового кольца проникают в металл и нейтрализуют положительные заряды поверхности ртути, в результате чего монослой плоско расположенных молекул, характеризуемый наличием электронных дырок, начинает играть роль положительно заряженной поверхности металла, к которой притягиваются анионы хлора. Емкость двойного слоя в этом случае определяется только ионами хлора и молекулами растворителя. [24]
Смещение максимума электрокапиллярной кривой в сторону отрицательных потенциалов и преимущественная адсорбция на положительно заряженной поверхности ртути увеличивается с ростом числа бензольных колец. Эти наблюдения указывают, что возникновение отрицательных скачков потенциала при адсорбции ароматических углеводородов не требует наличия полярной группы а, очевидно, обусловлено свойствами самого бензольного кольца, в котором связь между углеродными атомами осуществляется при помощи тт-электронов. Сопоставление электрокапиллярных кривых для ароматических и соответствующих гидроароматических соединений, не обладающих тг-электронами, например, бензола-циклогек-сана и нафталина-декалина, показывает, что гидроароматические углеводороды, не имеющие ароматической природы, не адсорбируются на положительно заряженной поверхности металла, а ведут себя подобно алифатическим соединениям, смещая максимум электроканиллярной кривой в сторону положительных потенциалов. [25]
Частицы вещества у поверхности электрода могут удерживаться силами физической или химической природы. Соответственно различают физическую и химическую адсорбцию. При физической адсорбции связи между атомами на поверхности электрода взаимно насыщены и поверхность инертна. При химической ( специфической) адсорбции между адсорбентом и адсорбатом происходит перенос электронов, или я-электронное взаимодействие. В зависимости от природы адсорбата и адсорбента может наблюдаться тот или другой вид адсорбции. При погружении металла в раствор электролита заряженная поверхность металла притягивает ионы противоположного знака и образуется двойной электрический слой. [26]
Страницы: 1 2