Отрицательно заряженная поверхность - металл
Cтраница 1
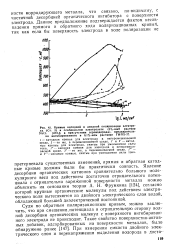
Отрицательно заряженная поверхность металла путем двух последовательных туннельных переходов заряжает и молекулу углеводорода, которая может находиться на расстоянии нескольких ангстремов от поверхности. Рекомбинация ионов Н с отрицательно заряженными молекулами приводит к гидрированию. [1]
При соударении таких частиц с отрицательно заряженной поверхностью металла на нем возникает защитная пленка ингибитора. В нашем случае можно предположить, что при наличии в водной среде постороннего ПАВ происходит адсорбция его молекул на межфазной поверхности раздела мицелл и микрокапелек. В результате этого ассоциаты из молекул ингибитора теряют способность взаимодействовать ( адсорбироваться) на поверхности металла или образовывать на ней достаточно эффективные экранирующие слои. [2]
Анионы адсорбируются лишь на положительно или слабо отрицательно заряженной поверхности металла. Катионы адсорбируются на отрицательно или слабо положительно заряженной поверхности и полностью десорбируются при достижении достаточно положительного заряда. [3]
 |
Схема процесса поверхностного растворения металла в воде.| Двойной электрический слой на границе цинк-вода. [4] |
Вследствие электростатических сил гидратированные катионы металла, притягиваясь отрицательно заряженной поверхностью металла, концентрируются около нее. [5]
Это взаимодействие может быть чисто электростатическим ( например, катионы притягиваются к отрицательно заряженной поверхности металла) или специфическим, обусловленным более сложными ( например, ковалентными) силами взаимодействия поверхности металла с адсорбированными частицами. Отрицательная адсорбция может быть вызвана или втягиванием сильно сольватированных частиц с поверхности в объем раствора, или отталкиванием ионов от одноименно заряженной поверхности электрода. [6]
Это взаимодействие может быть чисто электростатическим ( например, катионы притягиваются к отрицательно заряженной поверхности металла) или специфическим, обусловленным более сложными ( например, ковалентны-ми) силами взаимодействия поверхности металла с адсорбированными частицами. [7]
Явление десорбции органических катионов сравнительно большого молекулярного веса под действием достаточно отрицательного потенциала с отрицательно заряженной поверхности металла можно объяснить на основании теории А. Н. Фрумкина [124], согласно которой крупные органические молекулы под действием электрического поля вытесняются из двойного электрического слоя водой, обладающей большей диэлектрической постоянной. [9]
Если предположить, что адсорбция происходит только за счет электростатического взаимодействия катионов ингибитора с отрицательно заряженной поверхностью металла через слой молекулярного сероводорода, то поскольку слой сероводорода может только ослабить это взаимодействие, эффективность защиты в этом случае должна была бы несколько снизиться, Следует допустить поэтому наличие специфической адсорбции катионов ингибитора на поверхностном слое сероводорода. Адсорбируясь на слое сероводорода, катионоактивный ингибитор создает энергетический барьер за счет ф - - потенциала, который препятствует подводу ионов гидроксония. Ингибитор таким образом блокирует молекулы сероводорода, уменьшая образование ионов сульфония. [10]
Известно также, что для того чтобы вырвать атом из кристаллической решетки и удалить положительно заряженный ион из отрицательно заряженной поверхности металла, необходимо произвести определенную работу с затратой некоторого количества энергии, идущей на увеличение потенциальной энергии каждой частицы. Оторванный от поверхности ион металла находится в окружении молекул воды и ионов растворенных в ней составных частей дисперсной фазы. При этом он незамедлительно вступает в новые связи, отдавая часть потенциальной энергии. [11]
Мы видели, что нулевая точка, соответствующая максимуму электрокапиллярной кривой, как бы разграничивает области потенциалов, соответствующих положительно и отрицательно заряженным поверхностям металла, а следовательно, представляет собой границу раздела с преимущественной адсорбцией катионов или анионов из раствора, в котором этот металл находится. Это обстоятельство оказывает большое влияние на кинетику неравновесных электродных процессов, определяя их характер и направление. [12]
Мы видели, что нулевая точка, соответствующая максимуму электрокапиллярной кривой, как бы разграничивает области потенциалов, соответствующих положительно и отрицательно заряженным поверхностям металла, а следовательно, представляет собой границу раздела с преимущественной адсорбцией катионов или анионов из раствора, в котором этот металл находится. [13]
 |
Строение двойного скачка потенциала в. [14] |
Последующие более точные измерения показали, что емкость двойного слоя зависит от природы ионов, образующих его внешнюю, расположенную в растворе обкладку. Для гладкой отрицательно заряженной поверхности металла ( например, ртути), на которой адсорбированы катионы, емкость двойного слоя имеет порядок 18 мкР / см2 и примерно вдвое больше этой величины при положительном заряде поверхности металла, когда на ней адсорбируются анионы. [15]
Страницы: 1 2 3