Повышение - концентрация - растворенное вещество
Cтраница 2
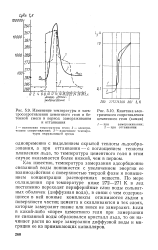 |
Изменение температуры и электросопротивления цементного геля и бетонной смеси в период замораживания.| Кинетика электрического сопротивления цементного геля ( камня. [16] |
Как известно, температура замерзания адсорбционно связанной воды понижается с увеличением энергии ее взаимодействия с поверхностью твердой фазы и повышением концентрации растворенных веществ. По мере охлаждения при температуре ниже 272 - 271 К в лед постепенно переходят периферийные слои воды сольват-ных оболочек ( диффузная вода), в связи с чем содержащиеся в ней ионные комплексы отжимаются льдом к поверхности частиц цемента и скапливаются в тех слоях, которые замерзают позже или вовсе не замерзают. Ьсли в какой-либо поре цементного геля при замерзании не связанной воды образовался кристалл льда, то он начинает расти по мере замерзания диффузной воды и миграции ее из примыкающих капилляров. [17]
 |
Схема действия ных сил. [18] |
Из происходящих в поверхностях фаз явлений, связанных с некомпенсированной поверхностной энергией, важное значение для промывочных жидкостей имеет адсорбция - самопроизвольное явление повышения концентрации растворенного вещества на границе раздела фаз по сравнению с концентрацией этого вещества во всем объеме дисперсной системы. [19]
Приведенные данные показывают, что для растворов сульфида бария при изменении концентрации и температуры наблюдается обычная закономерность в изменении изученных нами физико-химических свойств: с повышением концентрации растворенного вещества d увеличивается, С р и К уменьшаются; с повышением температуры d уменьшается, Ср и X увеличив аются. [20]
Опыты показали, что защитное действие ( с карбоксипептидазой в качестве индикатора) некоторых веществ ( глюкоза, тиомочевина, муравышоки-слый натрий, диметилтиомочевина) понижается с повышением концентрации растворенного вещества. Это явление изменения частного толковалось в том смысле, что, хотя молекулы защитного вещества способны удалять свободные радикалы, они остаются в активном состоянии и могут в свою очередь инактивировать молекулы индикатора. [21]
Наконец, некоторое количество воды приходится сбрасывать из системы, для того чтобы предупредить чрезмерное повышение солесодержания циркулирующей в ней воды. Повышение концентрации растворенных веществ создает опасность накипеобразования в трубках конденсаторов и коррозионных разрушений их материала. В районах с высокоминерализованными водами продувка может быть и больше. Это количество воды и приходится подавать в систему такого охлаждения. [22]
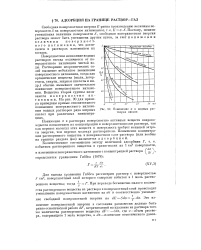 |
Понижение а в водных растворах кислот. [23] |
Понижение а в растворах поверхностно активных веществ сопровождается повышением их концентрации в поверхностном слое раствора, так как перенос молекул этих веществ в поверхность требует меньшей затраты энергии, чем перенос молекул растворителя. Повышение концентрации растворенного вещества в поверхностном слое раствора ( или вообще на границе раздела фаз) называется адсорбцией. [24]
Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен и не всегда практически осуществим. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности. [25]
 |
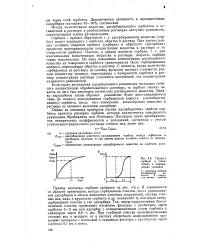
Процесс сорбции в статических ( а и динамических ( б условиях. [26] |
При прочих равных условиях скорости протекания прямого ( сорбция) и обратного ( десорбция) процессов пропорциональны концентрации вещества в растворе и на поверхности сорбента. По мере повышения концентрации растворенного вещества на поверхности сорбента увеличивается число сорбированных молекул, переходящих обратно в раствор. С момента, когда количество сорбируемых из раствора ( в единицу времени) молекул ста-новится равным количеству молекул, переходящих с поверхности сорбента в раствор, концентрация раствора становится постоянной; эта концентрация называется равновесной. [27]
Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен и не всегда практически осуществим. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящей в них концентрации компонентов ввести активность. [28]
 |
Процесс сорбции в статических и динамических условиях. [29] |
При прочих равных условиях скорости прямого ( сорбция) и обратного ( десорбция) процессов пропорциональны концентрации вещества в растворе и на поверхности / сорбента. По мере повышения концентрации растворенного вещества на поверхности сорбента увеличивается число сорбированных молекул, переходящих обратно в раствор. С момента, когда количество сорбируемых из раствора ( в единицу времени) молекул становится равным количеству молекул, переходящих с поверхности сорбента в раствор, концентрация раствора становится постоянной; эта концентрация называется равновесной. [30]
Страницы: 1 2 3 4