Повышение - перенапряжение - водород
Cтраница 1
Повышение перенапряжения водорода обычно понижает скорость коррозии стали в кислотах. Наблюдается, что присутствие в сталях S или Р увеличивает скорость коррозии. Это увеличение, по-видимому, является результатом низкого перенапряжения водорода на сульфиде или фосфиде железа, находящихся в стали в виде отдельной фазы или в виде поверхностного соединения, образованного при взаимодействии железа с H2S или с соединениями фосфора в растворе. Также возможно [2], что последние соединения, кроме того, стимулируют реакцию анодного растворения Fe - Fe2 2e ( понижая активационную поляризацию) или меняют соотношение площадей анода и катода. Этот вопрос требует дальнейшего изучения. [1]
Влияние ингибиторов при травлении стали в серной кислоте сводится к повышению перенапряжения водорода на микрокатодах стали, вследствие чего растворение ее замедляется. На скорость растворения окислов железа ингибиторы оказывают небольшое влияние, что объясняется [12] незначительной адсорбцией их на окислах и тем, что на окалине процесс протекает с окислительной деполяризацией без выделения газообразного водорода. [2]
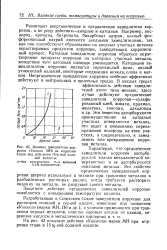 |
Влияние замедлителя коррозии Уникол МН на коррозию стали под действием 15 % - ной соля. [3] |
Эти вещества адсорбируются преимущественно на катодных участках поверхности металла, что ведет к повышению перенапряжения водорода на этих участках, а следовательно, к замедлению или прекращению коррозии металла. [4]
Увеличение скорости восстановления малеиновой кислоты при отравлении электрода большим количеством ртути можно объяснить тем, что вследствие повышения перенапряжения водорода на катоде увеличивается скорость процесса электрохимического восстановления. [5]
Сопоставляя кривые, представленные на рис. 1, с кривыми, полученными на вращающемся медном катоде в 5 10 - 3 M H2S04 с добавками MgS04 ( рис. 3), не трудно заметить, что различие в повышении перенапряжения водорода выше предельного тока ионами Na и Mg2 выражено еще более отчетливо. [6]
Более детальный анализ данных катодной поляризации, полученных на одном и том же электроде в 5 10 - 3 M H2S04 с добавками одновалентных ионов Na, K и двухвалентных - Mn2, Mg2, показывает, что не только выше, но и ниже предельного тока наблюдается некоторая разница в повышении перенапряжения водорода, вызываемого добавками одно-и двухвалентных катионов. [7]
Легирование магния некоторыми элементами значительно повышает его коррозионную стойкость и жаростойкость, улучшает механическую прочность, а также технологические свойства. Его положительное влияние объясняют повышением перенапряжения водорода и образованием пленки из гидратированной окиси марганца. [8]
Введение в раствор H2SeO3 увеличивает катодную поляризацию при осаждении марганца. Увеличение выхода по теку связывается с повышением перенапряжения водорода на марганце, содержащем селен. [9]
При попадании в разлагатели солей жесткости на поверхности графита появляется беловатый налет гидроокисей и карбонатов магния и кальция, и активность графита снижается. Снижение его активности наблюдается также при попадании в разлагатель кремнекислоты и некоторых органических веществ, абсорбирующихся на поверхности графита и способствующих повышению перенапряжения водорода. [10]
При попадании в разлагатели солей жесткости на поверхности графита появляется беловатый налет гидроокисей и карбонатов магния и кальция, и активность графита снижается. Снижение его активности наблюдается также при попадании в разлагатель кремнекислоты и некоторых органических веществ, абсорбирующихся на поверхности графита и способствующих повышению перенапряжения водорода. [11]
К третьей группе отнесены металлы со сравнительно высоким перенапряжением водорода, на которых в данной среде визуально не наблюдалось образование губки. За исключением меди и таллия, выход на металлах третьей группы значительно выше, чем второй, и увеличивается сравнительно закономерно с повышением перенапряжения водорода. Наибольшие выходы триптофана получены на свинце и галлии. [12]
Оказалось, что при добавлении в щелочь таннина, силикагеля и фосфата натрия перенапряжение водорода повышается. Таким образом, было установлено, что процесс растворения железа в щелочах в присутствии SiO2, Na2HPO4, таннина замедляется вследствие образования этими веществами поверхностных соединений с железом, которые вызывают также повышение перенапряжения водорода. [13]
Исследования, проведенные по методу определения скорости разложения амальгамы, показали J18 ], что присутствие в рассоле 1 г / л ионов кальция способствует значительному увеличению каталитической активности железа, никеля, марганца и серебра. Кальций является ингибитором каталитического действия солей ванадия, молибдена, хрома и кобальта. Ингибирующее действие кальция на молибден и ванадий качественно может быть объяснено повышением перенапряжения водорода на этих металлах в присутствии кальция, а активирование действия серебра - снижением перенапряжения водорода на серебре в присутствии кальция. [14]
Наконец, установленные выше закономерности позволяют объяснить и влияние на перенапряжение водорода поверхностно-активных ионов и молекул. Адсорбция поверхностно-активных анионов, наоборот, приводит к уменьшению плотности положительных зарядов в плотной части двойного слоя и сдвигу ( - потенциала в отрицательную сторону, в результате чего концентрация ионов водорода в поверхностном слое возрастает, и перенапряжение водорода уменьшается. При адсорбции нейтральных молекул ( спиртов или кислот жирного ряда) обычно наблюдается повышение перенапряжения водорода, что объясняется затруднением подхода иона водорода к поверхности электрода и ослаблением действия электрического поля на энергию активации вследствие увеличения толщины двойного слоя. [15]
Страницы: 1 2