Повышение - перенапряжение - водород
Cтраница 2
Эти закономерности позволяют объяснить влияние на перенапряжение водорода поверхностно-активных ионов и молекул. При адсорбции нейтральных молекул ( спиртов или кислот жирного ряда) обычно наблюдается повышение перенапряжения водорода, что объясняется затруднением подхода иона водорода к поверхности электрода и ослаблением влияния электрического поля на энергию активации вследствие увеличения толщины двойного слоя. [16]
Исследования, проведенные по методу определения скорости разложения амальгамы, показали [245], что присутствие в рассоле ионов кальция в количестве 1 г / л способствует значительному возрастанию каталитической активности железа, никеля, марганца и серебра. Кальций является весьма заметным ингибитором по отношению к действию солей ванадия, молибдена, хрома и кобальта. Было показано, что ингибирующее действие кальция по отношению к молибдену и ванадию качественно может быть объяснено повышением перенапряжения водорода на этих металлах в присутствии кальция, а активирование действия серебра - снижением перенапряжения водорода на серебре в присутствии кальция. Усиление влияния примеси железа на кинетику разложения амальгамы натрия в присутствии ионов кальция обусловлено ухудшением смачивания металла амальгамой. Это было доказано опытами по амальгамированию железной проволочки на поверхности амальгамы натрия в рассоле. Оказалось, что при отсутствии кальция в растворе железная проволочка, прикоснувшись к поверхности амальгамы, вызывает бурное выделение водорода, но уже через 1 - 2 сек проволочка смачивается амальгамой и выделение водорода прекращается. Если же в растворе присутствует более 0 2 г / л ионов кальция, то выделение водорода на ней продолжается более часа, поскольку в течение этого срока не происходит полного смачивания лроволочки амальгамой. [17]
Исследования, проведенные по методу определения скорости разложения амальгамы, показали [245], что присутствие в рассоле ионов кальция в количестве 1 г / л способствует значительному возрастанию каталитической активности железа, никеля, марганца и серебра. Кальций является весьма заметным ингибитором по отношению к действию солей ванадия, молибдена, хрома и кобальта. Было показано, что ингибирующее действие кальция по отношению к молибдену и ванадию качественно может быть объяснено повышением перенапряжения водорода на этих металлах в присутствии кальция, а активирование действия серебра - снижением перенапряжения водорода на серебре в присутствии кальция. Усиление влияния примеси железа на кинетику разложения амальгамы натрия в присутствии ионов кальция обусловлено ухудшением смачивания металла амальгамой. Это было доказано опытами по амальгамированию железной проволочки на поверхности амальгамы натрия в рассоле. Оказалось, что при отсутствии кальция в растворе железная проволочка, прикоснувшись к поверхности амальгамы, - вызывает бурное выделение водорода, но уже через 1 - 2 сек проволочка смачивается амальгамой и выделение водорода прекращается. Если же в растворе присутствует более 0 2 г / л ионов кальция, то выделение водорода на ней продолжается более часа, поскольку в течение этого срока не происходит полного смачивания лроволочки амальгамой. [18]
Если разлагатели амальгамы питают очищенной ( после катионитной очистки) водой или конденсатом водяного пара, активность графита сохраняется в течение многих лет. При попадании в разлагатели солей жесткости на поверхности графита появляется беловатый налет гидроокисей и карбонатов магния и кальция; активность графита снижается. Снижение его активности наблюдается также при попадании в разлагатель кремневой кислоты и некоторых органических веществ, абсорбирующихся на поверхности графита и способствующих повышению перенапряжения водорода. [19]
Кроме указанных способов специальной подготовки к гальваническим покрытиям, ряд авторов предлагает применять пескоструйную обработку, после которой возможно непосредственное гальваническое покрытие деталей. Роль пескоструйной обработки до сих пор с достаточной полнотой не выяснена. Есть предположения, что окисная пленка неустойчива на шероховатых поверхностях, однако такие поверхности увеличивают сцепление. Очевидно, что повышение перенапряжения водорода на этих поверхностях также играет роль. Необходимо отметить, что изделия, обработанные песком и покрытые цинком, корродируют быстрее изделий, оцинкованных без пескоструйной подготовки. [20]
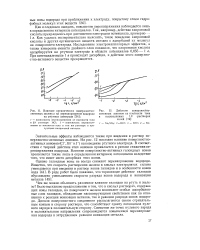 |
Влияние органических поверхностно-активных молекул на перенапряжение водорода на ртутном электроде.| Действие поверхностно-активных анионов на плотности тока в подкисленных 1Л растворах. [21] |
Было высказано предположение о том, что в кислых растворах, содержащих ионы галоидов, на поверхности железа возникают особые адсорбционные слои галоидов, обладающие пассивирующими свойствами как по отношению к реакции ионизации металла, так и реакции разряда ионов водорода. Диполи поверхностного соединения располагаются своим отрицательным концом в сторону раствора, что способствует сдвигу потенциала нулевого заряда в положительную сторону. Смещение же точек нулевого заряда в положительном направлении сопровождается повышением перенапряжения водорода и затруднением реакции ионизации металла. [22]
Олнако скорость коррозии тнт ша при повышении концен - П шш ХН4Р не возрастает бссг: ч дельно. Фишер [54] считает, что причиной резкого снижения скорости коррозионного растворения титана является образование на его поверхности гидрида титана. Однако это уменьшение скорости коррозии сопровождается смещением потенциала металла в отрицательную сторону и возрастанием перенапряжения водорода по мере добавления в кислоту NF F. Таким образом, наряду с гидридом на поверхности, вероятно, образуются какие-то другие соединения, возможно, фтористые соли титана, вызывающие повышение перенапряжения водорода. [23]
В активных средах для анодного покрытия скорость коррозии определяется разностью потенциалов контактирующих электродов ( покрытие - основа), а длительность защиты - скоростью растворения покрытия и его толщиной. Поэтому повышение коррозионной стойкости самого покрытия способствует увеличению долговечности системы покрытие - основа. В активных средах анодное растворение металлов протекает при поляризации анодного процесса менее значительной, чем для катодного. Контактный ток пары в этом случае определяется в основном перенапряжением катодного процесса и связан со вторичными явлениями, изменяющими поведение контактных пар. Методы, повышающие катодный контроль: например, повышение перенапряжения водорода для сред с водородной деполяризацией или уменьшение эффективности работы катодов, в том числе за счет вторичных явлений, будут способствовать снижению скорости саморастворения покрытия; и, наоборот, катодные включения с низким перенапряжением восстановления окислителя стимулируют коррозионное разрушение системы. [24]
Следует заключить, что не существует единого пути создания коррозионноетойкого сплава, как не существует и металлического сплава, устойчивого в любых условиях. В зависимости от условий коррозии пути подбора и создания коррозиои-ностойких сплавов будут весьма сильно видоизменяться. Легирование стали значительным количеством хрома ( переход к хромистым сталям) является совершенным методом защиты в условиях работы сплава в пассивном состоянии ( анодный контроль), но будет совершенно бесполезным при работе конструкции в неокислитель ной кислоте ( НС1, H2SO4), где протекает коррозия этих сталей с катодным контролем. Легирование титана большим количеством ( до1 32 %) молибдена повышает устойчивость сплава в солянокислых растворах, но будет вредно, если в этих растворах присутствуют окислители и кислород; наоборот, в этих средах более положительный эффект будет получен от модифицирования титана ничтожными присадками ( 0 2 - 0 5 %) палладия. Может быть приведено большое число подобных примеров. Общей ориентировкой может служить такое правило. Изменение состава сплава следует производить в том направлении, чтобы в предполагаемых условиях эксплуатации достигалось дальнейшее повышение основного контролирующего фактора коррозии. Например, если основной металл в данных условиях не склонен к пассивации и корродирует в активном состоянии с выделением водорода, то следует изыскивать методы изменения состава и структуры поверхности сплава, вызывающие повышение катодного контроля, например повышение перенапряжения водорода, снижение поверхности активных катодов. Для условий, в которых возможна пассивация основы сплава, наибольший эффект будет получен от добавления в сплав присадок, повышающих пассивируемость основы или повышающих эффективность катодного процесса. [25]
Страницы: 1 2