Повышение - валентность
Cтраница 2
Поэтому с повышением валентности ионов селективность адсорбции их ионитами возрастает. Соответственно этому двухвалентные ионы адсорбируются преимущественно перед одновалентными, трехвалентные - преимущественно перед двухвалентными. [16]
Поскольку при повышении валентности ЭО атомов растет, а длина связи уменьшается, увеличение степени окисления элементов приводит к увеличению числителя и уменьшению знаменателя формул (3.29) и (3.30), т.е. к увеличению частоты колебаний. [17]
Однако по мере повышения валентности исходного окисла эти возможности уменьшаются, и на поверхности высшего стабильного окисла растворение катиона должно приводить к образованию ячеек нестабильного соединения с аномально высокой для данного потенциала стандартной энергией, либо должно происходить только в тех статистически редких точках, где благодаря подходу катиона из глубины или благодаря кислородному обмену с раствором на короткий момент флуктуативно возникла ячейка низшего окисла. И то, и другое означает резкое уменьшение эффективной скорости анодного растворения поверхностных катионов, которое воспринимается как повышение степени запассивированности электрода. [18]
С другой стороны, повышение валентности центрального атома при неизменном координационном числе сопровождается уменьшением этого расстояния. Примерами могут служить ионы [ SbBre ] 3 - и [ SbBre ] -, в которых d ( CbBr) равны соответственно 2 80 и 2 56 А. [19]
Таким образом, с повышением валентности каждого из этих элементов возрастает их способность экстрагироваться, что, по-видимому, связано с повышением прочности их хлоридных комплексов. Платина и палладий извлекаются намного лучше остальных платиновых металлов, что позволяет разделять отдельные группы этих металлов при экстракции ( см. гл. Из рис. 5.26 видно, что в слабокислых растворах возможно отделение платины и палладия от остальных металлов, в сильнокислых средах - отделение платины от всех других металлов платиновой группы. [20]
Установлено, что с повышением валентности иона возрастает эффект понижения - потенциала. [21]
Установлено, что с повышением валентности иона возрастает эффект понижения С-потенциала. [22]
Установлено, что с повышением валентности иона возрастает эффект понижения С-потенциала. [23]
Процессы, связанные с повышением валентности реагирующих веществ ( образование катионов металла или его комплексных соединений, выделение кислорода, хлора и других газов из раствора), называются окислительными, или анодными. [24]
В начальной стадии окисления парафина повышение валентности марганца возможно с участием катализатора, кислорода и углеводорода. [25]
Марганец образует ряд окислов; повышение валентности металла в них сопровождается ослаблением основных свойств и усилением кислотных. Так, закись МпО и окись Мп2О3 имеют основной характер; двуокись МпО2 обладает амфотерными свойствами; высшие окислы марганца - МпО3 ( в свободном состоянии не получен) и Мп2О7 - ангидриды соответственно марганцовистой Н2МпО4 и марганцовой НМпО4 кислот. [26]
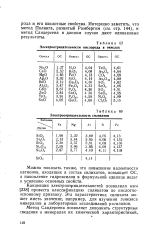 |
Электроотрицательности кислорода в окислах.| Электроотрицательность силикатов. [27] |
Можно показать также, что повышение валентности катионов, входящих в состав силикатов, повышает ОС, а накопление гидроксилов в формульной единице ведет к усилению основных свойств. [28]
Коагулирующая способность реагента возрастает с повышением валентности иона электролита. [29]
В ряде случаев токсичность возрастает с повышением валентности элемента. Например, окись марганца токсичнее закиси, шестивалентные соединения хрома токсичнее трехвалентных, двухвалентные же соединения хрома относительно малотоксичны. Имеются и обратные примеры: закисные соли железа токсичнее окис-ных, хотя и имеют меньшую валентность. [30]
Страницы: 1 2 3 4