Повышение - коррозионная стойкость - металл
Cтраница 1
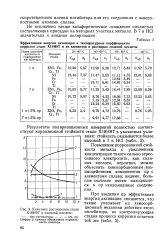 |
Кинетика растворения стали Х18Н9Т в соляной кислоте. - без ингибатора. - - - - - - - 5 % пр. [1] |
Повышение коррозионной стойкости металла с увеличением концентрации такого сильно агрессивного электролита, , как соляная кислота, вероятно, можно объяснить хемосорбционным взаимодействием компонентов пр с элементами сплава; видимо, большое значение имеют находящиеся в пр ненасыщенные соединения. [2]
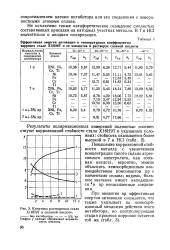 |
Кинетика растворения стали Х18Н9Т в соляной кислоте. [3] |
Повышение коррозионной стойкости металла с увеличением концентрации такого сильно агрессивного электролита, как соляная кислота, вероятно, можно объяснить хемосорбционным взаимодействием компонентов пр с элементами сплава; видимо, большое значение имеют находящиеся Тв пр ненасыщенные соединения. [4]
Повышение коррозионной стойкости металла тракта за деаэратором - поддержание значения рОН воды на уровне 5 - не может быть обеспечено аммиаком по причине ассоциации ионов ОН - и Н при нагреве воды с образованием молекул гидроокиси аммония; морфолин может выполнить эту функцию при избытке около 20 000 мкг / кг. Основным реагентом, обеспечивающим коррозионную защиту металла на этом участке тракта питательной воды, является гидразин. [5]
Примером повышения коррозионной стойкости металла легированием являются сплавы меди с золотом. [6]
Сущность методов повышения коррозионной стойкости металла заключается в уменьшении термодинамической и электрохимической неустойчивости металла, характеризуемой разностью обратимых потенциалов катодной и анодной реакций: Лф ( фк) обр - - ( фа) обр в пределах макро - и микрозон, и в увеличении общего кинетического торможения системы путем торможения анодного и катодного процессов. [7]
Весьма эффективно для повышения коррозионной стойкости металлов нанесение гальванических и химических покрытий. [8]
Металлические покрытия часто наносятся для повышения коррозионной стойкости металла подложки. Ниже будет описано несколько механизмов, с помощью которых это достигается. [9]
Количество легирующего элемента, нужное для повышения коррозионной стойкости металла, зависит от концентрации и температуры кислоты, давления, а также от механизма действия легирующего компонента. [10]
Количество легирующего элемента, нужное для повышения коррозионной стойкости металла, зависит от концентрации кислоты, ее температуры и давления, а также от механизма действия легирующего компонента. [11]
Катодная защита весьма перспективна как способ повышения коррозионной стойкости металлов, особенно не очень, электроотрицательных, таких, как никель, железо и их сплавы, стали в расплавленных солях. Однако при эхом необходимо иметь в виду, что при электролизе на катоде идет разряд катионов солей, например, щелочных и щел очно-земельных металлов. Их растворы в солевых расплавах термически неустойчивы. В результате катодная защита может сопровождаться улетучиванием щелочного, металла. [12]
Это эффективный ( хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивность металла. [13]
Легирование металлов - эффективный ( хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла. [14]
Ряд возрастания степени пассивности, естественно, не будет прямо соответствовать ряду повышения коррозионной стойкости металлов в данных условиях. Это объясняется тем, что коррозионная стойкость зависит не только от пассивности ( анодного торможения), но и от катодного торможения, и термодинамической стабильности металла в данных условиях. Магний, наоборот, несмотря на высокую степень своей пассивности недостаточно стоек в указанных условиях. Однако если бы магний не имел достаточно высокой степени пассивности, он в данных условиях ( исходя из низкой его термодинамической стабильности) должен был бы корродировать в десятки раз быстрее. [15]
Страницы: 1 2 3