Погрешность - величина
Cтраница 4
Вартенберг и Шютте [4171] измерили теплоту непосредственного взаимодействия кремния с элементарным фтором и нашли АЯ0 / 29з ( 51Р4, газ) - 359 7 2 6 ккал / моль. Вследствие больших трудностей, возникающих при проведении сжигания в элементарном фторе ( аналогией в этом отношении может служить углерод, для которого результаты измерения теплоты непосредственного сжигания во фторе оказались явно ошибочными), погрешность величины, полученной Вартенбергом и Шютте, может быть значительно больше, чем указывают авторы работы. В частности, Рысс [353, 354, 356] показал, что найденная таким методом теплота образования может оказаться значительно заниженной вследствие образования Si2pe и что правильное значение должно составлять 370 - 373 ккал / моль. [46]
Нетрудно видеть, что в случае метода эталонов нет необходимости точно знать плотность потока активирующего излучения, лишь бы она была постоянной по всему объему, занимаемому пробой и эталонами. Отпадает также требование к постоянству интенсивности активирующего излучения во времени. Погрешность величины сечения активации и изменения в энергетическом спектре активирующего излучения уже не оказывают влияния на конечные результаты. Абсолютные измерения заменяются относительными, которые в целом много проще и часто точнее. Все это вместе взятое заметно облегчает проведение активационного анализа и повышает точность определения. [47]
Классы точности этих величин определены по семибалльной системе. Классы точности Фу определяются по величине погрешности Фз000 цифрами, а классы точности величины теплового эффекта - по величине погрешности энергии диссоциации ( или теплоты сублимации) при 0 К буквами в соответствии с определением этих классов в таблице А Оценка точности величин Ф 000 дана в текстах разделов по расчетам термодинамических функций, оценка точности тепловых эффектов реакций основывалась на величинах погрешностей термохимических величин, принятых в 1 томе. Зная погрешности величин Ф и теплового эффекта реакции, нетрудно определить погрешность соответствующего значения константы равновесия. [48]
Ко второй группе относятся величины Д /, tlt ръ d, cp и р, которые оцениваются основной Допускаемой погрешностью, зависящей от класса точности применяемого прибора, или наибольшей ( максимальной) погрешностью табличных данных. Величины рн и ki, определяемые по справочным табличным данным, относятся также ко второй группе, так как они могут быть оценены только максимальной погрешностью. Доверительная вероятность погрешностей величин, отнесенных ко второй группе, неизвестна. [49]
В большинстве случаев принятые значения энергии связей в многоатомных молекулах даны с погрешностями. Значительно труднее определить погрешность величин, оцененных авторами различных работ; в ряде случаев такие величины даются без погрешностей. [50]
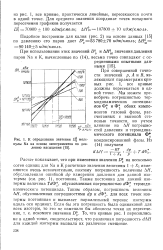 |
К определению значения D % моле - конденсированной фазы. Из кулы Na на основе экспериментов по дав - ( 14 получаем лению насыщения. пт. [51] |
Расчет показывает, что при изменении значения D 0 на несколько сотен единиц для Na и К расчетные значения величины 1 Х2 изменяются очень незначительно, поэтому погрешность величины ЛЯ, обусловленная ошибкой dp измерения давления для данной изотермы ( см. рис. 1), постоянна. Также постоянна для данной изотермы величина Td. Таким образом, погрешность величины АЯ, обусловленная погрешностями dp и d &, для всех точек изотермы постоянная и вызывает параллельный перенос изотермы вдоль оси ординат. То, что кривые рис. 1 пересеклись не в одной точке, свидетельствует, что различная погрешность d H для каждой изотермы вызвала их различное смещение. [52]
Результаты разделения теплот сольватации электролитов в неводных растворах показывают, что предположение ДЯ5 Л / ( о t ( 5) для неводных растворов приводит к несколько большим ошибкам, чем для водных. Причины этого очевидны: во-первых, больший вклад химической составляющей сольватации и, во-вторых, меньшая точность экспериментальных данных. Последнее обстоятельство позволяет допустить равенство ( в пределах погрешности величин АЯ) значений дДЯ / dr, для соответствующих ионов в воде и рассмотренных неводных растворах. [53]
При определении е основная трудность состоит в правильном определении истинной температуры. Вносимая при этом погрешность будет приблизительно одинаково искажать величину е, определяемую для разных длин волн. Таким образом при большой погрешности определения каждой из величин е г и еха погрешность величины р должна быть значительно ниже. [54]
Страницы: 1 2 3 4