Закись - титан
Cтраница 2
Титан образует следующие окислы: ТЮ - закись титана, Ti2O3 - окись титана и ТЮа - двуокись титана. Закись титана - основной окисел; соответствующие ему соли нестойки. [16]
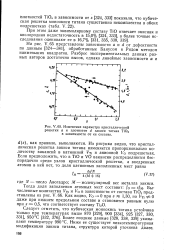 |
Изменение параметра кристаллической. [17] |
Более поздние данные [328, 338, 339] указывают температуру 990 С. Ниже ее существует низкотемпературная модификация закиси титана, структура которой уточнена далее. [18]
Вторым существенным кристаллографическим различием TiOi0 и VOi0 является то, что в первом проявляется дальний порядок, а во втором он отсутствует. Вероятно, ближний порядок в упорядочении вакансий играет важную роль в стехиометрической закиси титана. [19]
Интересно сравнить структурные свойства TiO и VO с NbO, к которому эти окислы очень близки по химическим свойствам. Однако термомеханическая обработка ( 1300 С, 50 - 60 кбар) закисей титана и ванадия снижает количество металлических и анионных вакансий в них. Это и приводит к резкому изменению их структурно-чувствительных свойств. [20]
Излишне высокая температура, как нам кажется, нежелательна из-за возможной реакции восстановления окиси кальция титаном и повышения концентрации металлического кальция в жидком металле. При температуре, превышающей 600 С, наблюдается загрязнение жидкого металла порошком металлического титана, который, вероятно, получается по реакциям разложения закиси титана 2TiO TiO2 Ti и ЗТЮ Ti2O3 Ti, хотя при этом достигается очень высокая степень очистки от кислорода, азота и водорода. [21]
Руду вначале подвергают восстановительной плавке в электродуговых или рудно-термических печах при температуре около 1600 С. В процессе плавки в зависимости от температуры образуются промежуточные окислы Т12О3 и TisOs ( Ti02 Ti203), которые способны растворять закись железа и ильменит, а также образовывать твердые продукты с окисью и закисью титана. [22]
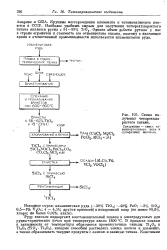 |
Схема по. [23] |
Руду вначале подвергают восстановительной плавке в электродуговых или рудно-термических печах при температуре около 1600 С. В процессе плавки в зависимости от температуры образуются промежуточные окислы Ti203 и Ti305 ( Ti02 - Ti203), которые способны растворять закись железа и ильменит, а также образовывать твердые продукты с окисью и закисью титана. [24]
Руду вначале подвергают восстановительной плавке в электродуговых или рудно-термических печах при температуре около 1600 С. В процессе плавки в зависимости от температуры образуются промежуточные оксиды TijOa и TisOs ( TiO2 - Ti2O3), которые способны растворять закись железа и ильменит, а также образовывать твердые продукты с оксидом и закисью титана. Конечными продуктами восстановительной плавки являются чугун и титановый шлак. [25]
Закись титана получают нагреванием смеси двуокиси с порошком титана в вакууме при 1550 С, а также восстановлением ТЮ2 магнием, алюминием или углеродом. Закись титана нерастворима в воде. С серной и соляной кислотами она реагирует с выделением водорода и образованием растворов трехвалентного титана. [26]
На воздухе при обычной температуре не изменяется. При высоких температурах реагирует с углеродом, кремнием, фосфором, серой и др. Растворим в серной, соляной и плавиковой кислотах, лучше всего в смеси плавиковой и азотной кислот. В соединениях титан бывает двух -, трех - и четырехвалентный. Наиболее устойчивы и имеют наибольшее практическое значение четырехвалентные соединения титана. С кислородом титан образует двуокись TiOa, окись Т120з и закись титана ТЮ. Двуокись титана встречается в природе главным образом в виде минерала рутила. При накаливании смеси двуокиси титана с углем в атмосфере галогена получаются галогениды титана, из которых наибольшее значение имеет четыреххлористый титан TiCU. На воздухе вследствие гидролиза сильно дымит. Продуктами гидролиза четырех-хлористого титана являются хлорангидриды о-титановой кислоты и хлористый водород. [27]
Страницы: 1 2