Электролитическая подвижность
Cтраница 1
Электролитическая подвижность является важнейшей характеристикой ионов, отражающей их специфическое участие в электрической проводимости растворов электролитов. С помощью закона Кольрауша и значений электролитических подвижностей ( табл. 37) можно легко вычислить молярную электрическую проводимость при бесконечном разведении соответствующих растворов. См / кмоль; растворы кислот, в силу большой скорости движения иона гидроксония, характеризуются значениями А, в 3 - 4 раза большими; растворы оснований характеризуются промежуточными значениями А. [1]
 |
Электролитические подвижности ионов в водных растворах электролитов при 298 К ( X, См - м кмоль. [2] |
Электролитическая подвижность зависит от скорости движения ионов, которая, в свою очередь, обратно пропорциональна их радиусам. Если рассмотреть щелочные металлы ( Li, , Na, К), то в указанном ряду истинные радиусы ионов увеличиваются и, следовательно, в такой же последовательности должна уменьшаться их подвижность. Однако, как видно из табл. 37, подвижность ионов при переходе от Li к К увеличивается почти в два раза. Таким образом, ионы в растворе и в кристаллической решетке имеют разные радиусы, причем чем меньше истинный ( кристаллохимический) радиус иона, тем больше его эффективный радиус в растворе электролита. [3]
Электролитическая подвижность не коррелируется со значениями истинных радиусов ионов из-за гидратации. [4]
 |
Электролитические подвижности ионов в водных растворах электролитов при 298 К ( X, См - м кмоль. [5] |
Электролитическая подвижность ионов зависит, кроме того, от температуры ( табл. 39) и вида растворителя. [6]
Причину возрастания электролитической подвижности от иона фтора к иону брома можно объяснить уменьшающейся гидратацией ионов, поскольку при переходе от хлора к брому в случае одного и того же катиона это проявляется в увеличении электролитического переноса воды в направлении к катоду ( ср. Так как величина электролитической подвижности обусловливается двумя факторами, действующими в противоположных направлениях ( а именно возрастание ионного объема - в направлении снижения, и уменьшение гидратной оболочки - в направлении повышения подвижности), то, вероятно, в этом и есть причина того, что в ряду электролитических подвиж-ностей галогенов у иона брома проявляется максимум. [7]
Причину возрастания электролитической подвижности от иона фтора к иону брома можно объяснить уменьшающейся гидратацией ионов, поскольку при переходе от хлора к брому в случае одного и того же катиона это проявляется в увеличении электролитического переноса воды в направлении к катоду ( ср. Так как величина электролитической подвижности обусловливается двумя факторами, действующими в противоположных направлениях ( а именно возрастание ионного объема - в направлении снижения, и уменьшение гидратной оболочки - в направлении повышения подвижности), то, вероятно, в этом и есть, причина, что в ряду электролитических подвижностей галогенов у иона брома проявляется максимум. [8]
Причину возрастания электролитической подвижности от иона фтора к иону брома можно объяснить уменьшающейся гидратацией ионов, поскольку при переходе от хлора к брому в случае одного и того же катиона это проявляется в увеличении электролитического переноса воды в направлении к катоду ( ср. Так как величина электролитической подвижности обусловливается двумя факторами, действующими в противоположных направлениях ( а именно возрастание ионного объема - в направлении снижения, и уменьшение гидратной оболочки - в направлении повышения подвижности), то, вероятно, в этом и есть причина, что в ряду электролитических подвижностей галогенов у иона брома проявляется максимум. [9]
АО берется сумма электролитических подвижностей аниона и катиона при бесконечном разведении. [10]
Кк и Ха соответственно) и называются электролитическими подвижностями. [11]
Гидратация сильно влияет на многие свойства ионов, например на электролитическую подвижность и на потенциал выделения ( см. стр. Особенно сильно влияет, гидратация на ион водорода. Ион гидроксония [ Н30 ], полученный в результате присоединения к протону молекулы воды, ведет себя совсем иначе, чем вел бы себя свободный протон. Раньше уже было отмечено, что прочность связи протона с одной молекулой воды особенно велика. В других гидратированных ионах молекулы воды связаны слабее, чем в ионе гидроксония. Их энергии связи уже не достигают той величины, которая получается если разделить теплоту гидратации ионов ( значения которой, например, приведены в табл. 28 для щелочных ионов) на число молей связанной с данным ионом воды. Ионы гидроксония также оказывают ориентирующее действие на окружающие молекулы воды. Для них, однако, при наличии большой энергии связи протона эта энергия ориентации численно едва ли имеет значение. [12]
 |
Гидратация ионов в 1 н. растворе по данным Реми. [13] |
Гидратация сильно влияет на многие свойства ионов, например на электролитическую подвижность и на потенциал выделения ( см. стр. Особенно сильно влияет гидратация на ион водорода. Ион гидроксония [ Н30 ], полученный в результате присоединения к протону молекулы воды, ведет себя совсем иначе, чем вел бы себя свободный протон. [14]
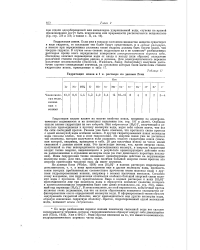 |
Гидратация ионов в 1 н. растворе по данным Реми. [15] |
Страницы: 1 2