Закон - амаг
Cтраница 2
Если смесь идеальна ( см. раздел VI.20), то для нее справедлив закон Амага, который гласит, что объемы чистых компонентов аддитивны при постоянных давлении и температуре. [16]
Уравнение ( 8 - 29) означает, что в общем случае для такой смеси несправедлив и закон Амага. [17]
Уравнение ( 8 - 29) означает, что в общем случае для такой смеси несправедлив и закон Амага. [18]
В некоторых случаях, даже когда компоненты, составляющие смесь, являются неидеальными газами, смесь в целом достаточно хорошо подчиняется закону Амага. [19]
Входящий в уравнение коэффициент сжимаемости ZCM данной газовой смеси рассчитывают по-разному, смотря по тому, какое исходное положение кладется в основу его определения - закон Дальтона, закон Амага или правило аддитивности псевдоприве-денных свойств газовой смеси. [20]
Поскольку в этом отношении закон Гиббса - Дальтона и закон Дальтона синонимичны, совершенно очевидно, что смесь идеальных газов, подчиняющихся закону Гиббса - Дальтона, удовлетворяет также закону Амага ( этот закон относится к парциальным объемам, определенным в разд. Для такой смеси идеальных газов также существует связь между парциальным давлением и мольной долей ( см. разд. Дальтона), когда парциальное давление определено через мембранное равновесие. Прямое доказательство этого приводится в следующем разделе. [21]
Ввиду того что в пласте углеводороды находятся под давлением, значительно превышающим их критическое, при котором исчезает различие между газообразной и жидкой фазами, мы считаем закономерным, пользуясь законом Амага, вычислять величины z по данным жидкого состояния. [22]
Для идеальных газов оба закона являются точными. Закон Амага, вообще, несколько более точен, но даже при умеренных давлениях также оказывается только приближенным. Более близкие приближения для описания свойств газовых смесей требуют разработки методов подбора констант в уравнении состояния (4.1) чистых газов. В [27] изложены соображения по этим вопросам. [23]
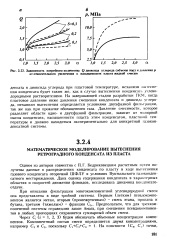 |
Зависимость потребного количества Q диоксида углерода ( объемы пор и давления р от относительного увеличения а насыщенности пласта жидкой смесью. [24] |
При описании фильтрации многокомпонентной углеводородной смеси она представлена в виде тройной системы. Предполагаем, что для трехком-понентной системы справедлив закон Амага, при смешении псевдокомпонентов в любых пропорциях сохраняется суммарный объем смеси. [25]
В [7] рассмотрен случай отсутствия межфазного массообмена водной и нефтяной компонентами. В отличие от предположения о постоянстве плотностей фаз [38] предполагается выполнение закона Амага о постоянстве суммарного объема фаз в процессе массообмена. При этом механизм эффективного вытеснения состоит в переходе нагнетаемой активной компоненты в нефтяную фазу; в общем случае [10] он состоит также во взаимном растворении. Для видов треугольных фазовых диаграмм, соответствующих немонотонным изотермам распределения примеси по фазам, получены решения, в которых изменение концентрации на фронте вытеснения достигается последовательностью скачков и участков непрерывного изменения. Первый интеграл движения тыла оторочки, найденный в [9], позволил дать геометрическую интерпретацию динамики тыла оторочки. Получены формулы средней нефтенасыщенности во всех зонах, на основе чего развита графоаналитическая техника расчета показателей процесса. [26]
Наиболее известным является правило Льюиса и Рендалла [14], основанное на законе Амага. [27]
Наиболее известным является правило Льюиса и Рендалла [14], основанное па законе Амага. [28]
Парциальный объем данного газа в смеси газов определяется, как такой объем, который занимал бы этот газ, если бы он один находился при тех же температуре и давлении, что и смесь газов. Если выполняются законы идеальных газов, то должен быть также справедлив и закон Амага - сумма парциальных объемов равна общему объему. [29]
Иногда свойства смеси определяют Путем простого суммирования таких же свойств компонентов. Так, упругость паров смеси взаимно нерастворяющихся жидкостей, например воды и жидких углеводородов, равна сумме упругостей паров этих жидкостей; общее давление и объем газовой смеси находятся как сумма парциальных давлений и парциальных объемов компонентов ( закон Дальтона и закон Амага); объем некоторых жидких смесей - как сумма объемов отдельных компонентов. [30]
Страницы: 1 2 3