Подуровень
Cтраница 2
Но теперь нижний подуровень N-оболочки, способный удержать лишь 2 электрона, окончательно заполнен. И у следующих элементов электроны начинают размещаться на внешнем подуровне внутренней М - оболочки, который до этого момента пустовал. Этот процесс начинается со скандия ( номер 21) и завершается цинком ( номер 30), у которого внешний подуровень М - оболочки полностью заполнен 10 возможными электронами. В атоме цинка 30 электронов распределены таким образом: 2 - на К оболочке. [16]
Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. У атома углерода два неспаренных электрона. Справа от схемы в электронной формуле дана более подробная запись с указанием расположения электронов на рх - и / - орбиталях. Такую запись также часто применяют. [17]
Для подуровня s ( / 0) int принимает лишь одно значение, равное 0, следовательно, во 2 - м слое имеется лишь одна сферически симметричная атомная орбиталь, на которой могут находиться два электрона. [18]
Для подуровня s ( / 0) mi принимает лишь одно значение, равное 0, следовательно, во 2 - м слое имеется лишь одна сферически симметричная атомная орбиталь, на которой могут находиться два электрона. [19]
Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. У атома углерода два неспаренных электрона. Справа схемы в электронной формуле дана более подробная запись о указанием расположения электронов на рх - и ду-орбиталях. И такую запись также часто применяют. [20]
 |
Расщепление уровня энергии - SV-H, электрона в постоянном магнитном поле. [21] |
Два подуровня соответствуют двум возможным ориентация спина - по направлению вектора поля и против него. Если образец, содержащий неспаренные электроны, находится в потоке электромагнитных волн с частотой v, то возможен переход электрона с одного уровня на соседний. [22]
Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. У атома углерода два неспаренных электрона. Справа от схемы - в электронной формуле дана более подробная запись с указанием расположения электронов на рх и ри-орбиталях. И такую запись также часто применяют. [23]
 |
Расщепление уровня энергии Е gu. H, электрона в постоянном магнитном поле. [24] |
Два подуровня соответствуют двум возможным ориентациям спина - по направлению вектора поля и против него. Если образец, содержащий неспаренные электроны, находится в потоке электромагнитных волн с частотой v, то возможен переход электрона с одного уровня на соседний. [25]
Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. У атома углерода два неспаренных электрона. Справа от схемы в электронной формуле дана более подробная запись с указанием расположения электронов на рх - и р - орбиталях. И такую запись также часто применяют. [26]
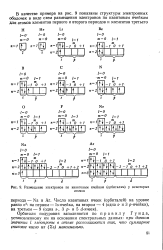 |
Размещение электронов по квантовым ячейкам ( орбиталям у некоторых. [27] |
Орбитали подуровня заполняются по правилу Гунда, установленному им на основании спектральных данных: при данном значении I электроны в атоме располагаются так, что суммарное спиновое число их ( Zs) максимально. [28]
Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. У атома углерода два неспаренных электрона. Справа от схемы в электронной формуле дана более подробная запись с указанием расположения электронов на рх -, ру - и рг-орбиталях. И такую запись также иногда применяют. [29]
Заполнение подуровня электронами проводится, пока не будут исчерпаны все варианты. [30]
Страницы: 1 2 3 4