Закон - бойль
Cтраница 1
Закон Бойля - Мариотта для газов при столь малом давлении применим вполне, но на этот раз мы сделали другое упущение: считали температуру воздуха одинаковой по всей 20-километровой толще, между тем как она заметно падает с высотой. В среднем принимают, что температура при поднятии на каждый километр падает на 6 5 С; так происходит до высоты 11 км, где температура равна - 56 С и далее на значительном протяжении остается неизменной. Если принять это обстоятельство во внимание ( для чего уже недостаточны средства элементарной математики), получатся результаты, гораздо более согласующиеся с действительностью. По той же причине на итоги наших прежних вычислений, относящихся к давлению воздуха в глубинах, нужно тоже смотреть как на приближенные. [1]
Закон Бойля устанавливает, что при постоянной температуре давление газа обратно пропорционально его объему. [2]
Закон Бойля - Мариотта для газов выполняется для всех газов при достаточно низких значениях плотности, когда молекулы удалены друг от друга на расстояния, большие по сравнению с их собственными размерами. Этот закон выполняется и при более высоких плотностях для газов, состоящих из простых молекул, вроде кислорода или водорода, но не для газов, состоящих из больших и сложных молекул, например паров спирта. Изучение отклонений от закона Бойля - Мариотта является одним из путей к более детальному и всестороннему исследованию молекул. Здесь мы ограничимся областью низких плотностей, что соответствует более простым закономерностям. [3]
Закон Бойля и Мариотта справедлив в тех случаях, когда вмешательство сил взаимодействия в жизнь молекул газа совершенно незаметно. [4]
Закон Бойля - Мариотта, описывающий физическое состояние идеальных газов, формулируется следующим образом: произведение абсолютного давления и удельного объема идеального газа при постоянной температуре сохраняет неизменную величину. [5]
Закон Бойля - Мариотта объясняется молекулярно-кинетиче-ской теорией вещества следующим образом. В своем беспорядочном движении молекулы газа ударяются о стенки сосуда. [6]
Закон Бойля устанавливает, что при постоянной температуре объем известной массы обратно пропорционален давлению. [7]
Закон Бойля - Мариотта неоднократно проверялся на опыте. Оказалось, что при давлениях, не превосходящих нескольких десятков атмосфер, и при сравнительно высоких температурах ( порядка комнатных и выше) он выполняется довольно хорошо. [8]
Закон Бойля и Мариотта неоднократно проверялся на опыте. Оказалось, что при давлениях, не превосходящих нескольких десятков атмосфер, и при сравнительно высоких температурах ( порядка комнатных и выше) он выполняется довольно хорошо. Однако при давлениях порядка сотен атмосфер и выше экспериментальные значения произведения pV уже значительно отличаются от теоретических. [9]
Закон Бойля выражает связь между давлением и объемом газа при постоянной температуре. [10]
Закон Бойля - Мариотта показывает, как изменяется давление газа с изменением его объема при постоянной температуре и, конечно, при неизменной массе. [11]
Закон Бойля - Мариотта устанавливает зависимость между объемом данной массы газа и давлением при неизменности прочих условий. Закон гласит: лри постоянной температуре объемы данной массы газа обратно пропорциональны давлениям. [12]
Закон Бойля отражает поэтому только часть действительности. Но, строго говоря, влияния, которыми мы пренебрегаем, когда пользуемся этим законом, существуют всегда, как бы малы они ни были; ими-то и обусловливаются отступления от закона Бойля. [13]
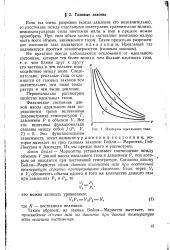 |
Изотермы идеального газа. [14] |
Закон Бойля - Мариотта устанавливает соотношение между объемом V данной массы идеального газа и давлением Р, под кото -, рым он находится при постоянной температуре. [15]
Страницы: 1 2 3 4