Закон - первый порядок
Cтраница 1
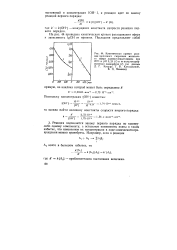
Закон Генри первого порядка может дать нам некоторую - информацию о взаимодействиях в растворе. [1]
Отклонение от закона первого порядка ( рис. 35, кривая 2) на глубоких стадиях превращения связано с накоплением гидроперекиси. При малых концентрациях инициатора скорость инициирования за счет распада инициатора делается сравнимой со скоростью инициирования за счет распада накопившейся гидроперекиси и полулогарифмическая анаморфоза искривляется. [2]
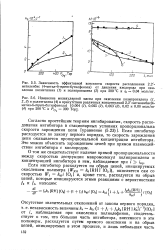
Реакция подчиняется закону первого порядка по какому-либо одному компоненту, а остальные компоненты Взяты в таком избытке, что изменением их концентрации в ходе химического превращения можно пренебречь. [3]
Реакция подчиняется закону первого порядка по какому-либо одному компоненту, а остальные компоненты взяты в таком избытке, что изменением их концентрации в ходе химического превращения можно пренебречь. [5]
Они подчиняются закону первого порядка по концентрации. Если начальная концентрация удваивается, то и скорость реакции также удваивается. [6]
В разветвленных углеводородах закон первого порядка соблюдается достаточно хорошо в значительно более широком интервале. [7]
Зародышеобразование происходит по закону первого порядка. Оба случая рассмотрены в двух последующих разделах. [8]
Реакцию, протекающую по закону первого порядка, проводили в реакционном сосуде, температура которого постепенно понижалась по закону Т0 - Т ( о т), где Т0 - начальная температура; Т - температура в момент времени т; а - постоянная. Определите энергию активации реакции, если величина а при 323 и 373 К одинакова. [9]
Если ингибитор расходуется по закону первого порядка, то скорость зарождения цепи оказывается пропорциональной концентрации ингибитора. [11]
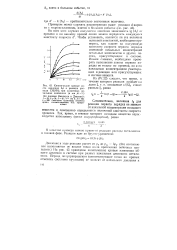 |
Кинетические кривые ро - t. [12] |
Иными словами, необходимо проверять выполнение закона первого порядка не только по времени, но и по начальным концентрациям участвующих в реакции или присутствующих в системе веществ. [13]
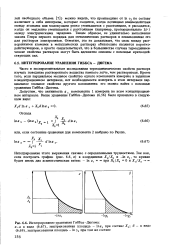 |
Интегрирование уравнения Гиббса-Дюгема. [14] |
Таким образом, не удивительно выполнение закона Генри первого порядка для металлических растворов и невыполнение его для растворов электролитов. Отметим, это не доказывает, что силы между растворенными атомами в металлических растворах обязательно являются короткодействующими, а просто свидетельствует, что в большинстве случаев термодинамические свойства растворов могут быть адекватно описаны с помощью краткодей-ствующих сил. [15]
Страницы: 1 2 3 4