Закон - первый порядок
Cтраница 2
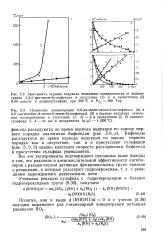
Итак, рассмотрим реакцию, подчиняющуюся закону первого порядка, например реакцию разложения этана на этилен и водород. Если реакция инициирования протекает по первому порядку, то для объяснения наблюдаемого общего первого порядка реакции необходимо предположить, что цепи обрываются по реакции атома водорода с этиль-ным радикалом. [16]
Выражение (11.137) соответствует образованию зародышей по закону первого порядка. [17]
При высоких давлениях, когда диссоциация следует закону первого порядка, рекомбинация описывается законом второго порядка. Если К выразить через статистические суммы молекул АВ и образующихся при их распаде радикалов А и В, и воспользоваться формулой метода переходного состояния (19.16) для йдисс, то / Срек опишется общей формулой (11.9) для реакции второго порядка. [18]
Каталитические мономолекулярные реакции не обязательно должны подчиняться закону первого порядка. Скорость реакции не пропорциональна концентрация [ АВ ], так как [ АВ ] стоит не только как множитель в числителе, но и как слагаемое в знаменателе. [19]
Молекулярная масса полиокса падает при механодеструкции По закону первого порядка независимо от концентрации и исходной длины цепи [ 24, с. [20]
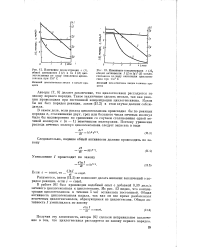
Бифенолы расходуются во время периода индукции по закону первого порядка как в отсутствие, так и в присутствии сульфидов ( рис. 5, 9, б) однако константа скорости расходования бифенола в присутствии сульфида уменьшается. [22]
В низкомолекулярных веществах аналогичные реакции хорошо описываются законом первого порядка. [24]
Если принять, что рост частиц происходит по закону первого порядка, то критический центр перхлората тетрафенилар-сония должен состоять из трех ионных пар; если же допустить, что рост описывается законом второго порядка, то критический центр кристаллизации этого вещества должен состоять из четырех ионных пар. Интересно отметить, что природа критического центра ниоксима никеля зависит от того, какой из реагирующих ионов, ниоксима или никеля, находится в избытке. Следует отметить, что теория Дьюка и Брауна основана на предположении, что после первоначального образования центров кристаллизации новых центров не образуется. [25]
Первая трудность теории Линдемана состоит в том, что закон первого порядка для скорости реакции сохраняется вплоть до более низких концентраций, чем это следует из теории, и требует для k значительно более высокого значения, чем получается при расчете-по. [26]
Авторы [7, 8] делают заключение, что циклогексанон расходуется по закону первого порядка. [28]
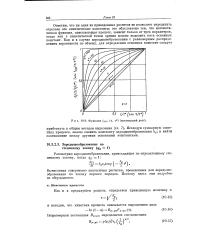 |
Функция / 3 ( о ( т, т ( трехмерный рост. [29] |
Вычисления совершенно аналогичны расчетам, проведенным для зародышеобразования по закону первого порядка. Поэтому здесь они подробно-не обсуждаются. [30]
Страницы: 1 2 3 4