Закон - разбавление
Cтраница 2
Попытки приложения закона разбавления к различным электролитам показали, что этот закон справедлив только для слабых электролитов. Сильные электролиты не подчиняются закону разбавления; для них величина К с увеличением концентрации непрерывно возрастает, что видно из следующей таблицы. [16]
Экспериментальная проверка закона разбавления была произведена двумя путями: по постоянству константы, вычисляемой из результатов определения электропроводности, и путем сравнения величин электропроводности, найденной экспериментально и вычисленной по уравнению. [17]
Каким уравнением выражается закон разбавления. [18]
Это уравнение выражает закон разбавления. [19]
Каким уравнением выражается закон разбавления. Между какими величинами он устанавливает зависимость. [20]
Выведенное уравнение выражает закон разбавления, являющийся частным случаем закона действующих масс в приложении к растворам слабых электролитов. Оно связывает между собой константу диссоциации электролита, степень диссоциации и концентрацию электролита. Закон разбавления дает возможность вычислять степень диссоциации при различных концентрациях, если известна константа диссоциации электролита. Наоборот, определив степень диссоциации при какой-нибудь концентрации, легко рассчитать константу диссоциации. [21]
Каким уравнением выражается закон разбавления. Между какими величинами он устанавливает зависимость. [22]
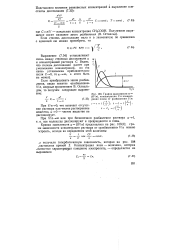 |
График зависимости а f ( V / n, концентрации С и концентрации ионов от разбавления Vim. [23] |
Полученное выражение носит название закон разбавления ( В. [24]
Полученное выражение носит название закон разбавления ( В. [25]
Сильные электролиты не подчиняются закону разбавления. [26]
Выражение это, называемое законом разбавления, связывает степень и константу диссоциации, позволяя тем самым вычислить одну величину из другой. [27]
Уравнение ( 2) выражает закон разбавления. Оно устанавливает зависимость между степенью диссоциации и концентрацией слабого электролита. С увеличением концентрации слабого электролита степень диссоциации его уменьшается, с уменьшением концентрации степень диссоциации возрастает. [28]
Дальнейшие исследования показали, что закон разбавления применим только к растворам слабых электролитов и неприменим к растворам сильных электролитов, так как при изменении их концентрации значение К не остается постоянным. [29]
Уравнение ( 2) выражает закон разбавления. Он устанавливает зависимость между степенью диссоциации и концентрацией слабого электролита. С увеличением концентрации слабого электролита степень диссоциации его уменьшается, с уменьшением концентрации степень диссоциации возрастает. Для весьма слабых электролитов, степень диссоциации которых очень мала, знаменатель в уравнении ( 2) может быть принят равным единице. [30]
Страницы: 1 2 3 4