Положение - водород
Cтраница 2
Поэтому понятно становится отдельное, самостоятельное положение водорода, обладающего низшим атомным весом. Судя по тому, что солеобразная его окись есть НЮ, что его соли суть НХ его должно причислить к I группе и ближайшим его аналогом будет [ поэтому ] Na, потому что он, как и водород, относится к нечетному ряду, к I группе. [16]
При обсуждении вопроса о положении водорода в первой или седьмой группе предпочтение отдается седьмой: строение внешнего ( и единственного) электронного слоя, до завершения которого недостает одного электрона, значение энергии ионизации, возможность отрицательной степени окисления, малый атомный радиус. [17]
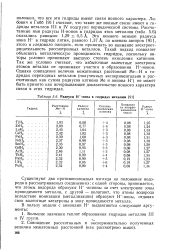 |
Радиусы Н - - иона в гидридах металлов. [18] |
Существуют два противоположных взгляда на положение водорода в рассматриваемых соединениях: с одной стороны, принимается, что атомы водорода образуют Н - - анионы за счет электронов зоны проводимости металла, с другой - полагают, что атомы водорода вследствие ионизации ( металлизации) образуют Н - - ионы, отдавая свои валентные электроны в зону проводимости металла. [19]
С позиций строения атома объяснимо положение водорода в периодической системе. Атом водорода имеет один внешний электрон, который может быть отдан атомам других элементов. Поскольку это свойство проявляют атомы всех элементов, начинающих периоды, - Li, Na, К, Rb, Cs, Fr, то и водород должен стоять в IA-группе. Так как в этом случае водород проявляет неметаллические свойства, он должен находиться в VIIA-группе. Эта двойственность в химическом поведении водорода заставляет помещать его в двух группах периодической системы элементов. При этом в одной из групп символ элемента заключают в скобки. [20]
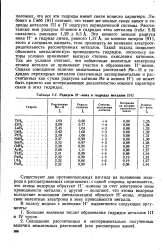 |
Радиусы Н - - иона в гидридах металлов. [21] |
Существуют два противоположных взгляда на положение водорода в рассматриваемых соединениях: с одной стороны, принимается, что атомы водорода образуют Н - - анионы за счет электронов зоны проводимости металла, с другой - полагают, что атомы водорода вследствие ионизации ( металлизации) образуют Н - - ионы, отдавая свои валентные электроны в зону проводимости металла. [22]
С позиций строения атома объяснимо положение водорода в периодической системе. Атом водорода имеет один электрон, который может быть отдан атомам других элементов. Так как это свойство проявляют атомы всех элементов, начинающих периоды - Li, Na, К, Rb, Cs, Fr, то и водород должен стоять в главной подгруппе I группы. [23]
С позиций строения атома объяснимо положение водорода в периодической системе. Атом водорода имеет один внешний электрон, который может быть отдан атомам других элементов. Поскольку это свойство проявляют атомы всех элементов, начинающих периоды - Li, Na, К, Rb, Cs Fr, то и водород должен стоять в IA-подгруппе. Так как в этом случае водород проявляет неметаллические свойства, он должен находиться в VIIA-подгруппе. Эта двойственность в химическом поведении водорода заставляет помещать его в двух группах периодической системы элементов. При этом в одной из групп символ элемента заключают в скобки. [24]
С позиций строения атома объяснимо положение водорода в периодической системе. Атом водорода имеет один электрон, который может быть отдан атомам других элементов. Поскольку это свойство проявляют атомы всех элементов, начинающих периоды - Li, Na, К, Rb, Cs, Fr, то и водород должен стоять в главной подгруппе I группы. Такая двойственность в химическом поведении водорода является причиной того, что его помещают в двух подгруппах. При этом в одной из подгрупп символ элемента заключают в скобки. [25]
С позиций строения атома объяснимо положение водорода в периодической системе. Атом вэдорода имснгг один электрон, который может быть отдан атомам друг и:; элементов. Поскольку это свойство проявляют атомы всех элементов, начинающих периоды, - Li, Na, К, Rb, Cs, Fr, то и водород долже i: тоять в главной подгруппе I группы. С другой стороны, поскольку атом водорода обладает способностью, подобно атомам галогенов, присоединять один электрон ( Н - f - е Н), т.е. проявляет неметаллические свойства, он должен находиться в главной подгруппе VII группы Такая двойственность в химическом поведении водорода является причиной того, что его помещают в двух подгруппах. При этом в одной из подгрупп символ элемента заключают в скобки. [26]
Так, хорошо известна неопределенность положения водорода. С другой стороны, хотя 14 актиноидов по аналогии с лантаноидами находятся в одной клетке с актинием, это их положение не вполне отвечает их химическим свойствам. Известно, что первые представители актиноидов - Th, Pa, U - часто проявляют степени окисления 4, 5, 6 соответственно. Именно на этом основании еще Д. И. Менделеев поместил эти элементы в IV, V и VI группы системы. Таким образом, можно отметить, ЧТОБ принятой в настоящее время форме периодической системы не соблюдается последовательно принцип химической аналогии. Помещение же этих элементов в VIIА - и VIIIA-группы ( среди р-элементов) с учетом свойств простых веществ неоправдано. [27]
 |
Структура флуорнта.| Структура рутила. [28] |
На рис. 1.87 черные кружки показывают положение водорода, а штриховка - область, где сосредоточен отрицательный заряд. Как видно из рис. 1.87, кристаллическая структура льда имеет полости, что обусловливает его низкую плотность, меньшую плотности воды. Полости в кристаллической решетке льда могут заполняться другими молекулами, например СЩ, HzS, одноатомными молекулами благородных газов, в результате чего образуются своеобразные химические соединения. Соединения, получаемые в результате включения в полости кристаллической решетки молекул других соединений, называют клатратами. [29]
 |
Кристаллические решетки модификаций сульфида цинка. в - сфалерит. б - вюртцит. маленькие шары - ионы 7л, большие - S.| Структура льда. [30] |
Страницы: 1 2 3 4