Кинетическая закономерность - реакция
Cтраница 1
Кинетические закономерности реакции изучали при тендера-туре 90 - 100 С по скорости поглощения кислорода к скор ли расхода бензилового спирта. [1]
 |
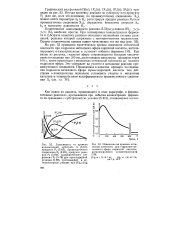
Зависимость эффективной константы скорости окисления 1 3-диоксолана гипохлоритом натрия от концентрации 1 3-диоксолана ( [ NaQO ] моль-л 1, 25 С, 1000 об / мин. [2] |
Кинетические закономерности реакции 1 3-диоксациклоалканов с гипохло-ритом натрия исследовали на примере ( /) при условии [ DH ] 0 [ NaClO ] 0, где [ DH ] 0, [ NaClO ] 0 - начальные концентрации 1 3-диоксолана и гипохлорита натрия соответственно. Показано, что в указанных условиях кинетические кривые расходования гипохлорита натрия с высоким коэффициентом корреляции г 0.99 описываются уравнением первого порядка. [3]
Кинетические закономерности реакции являются, в первую очередь, следствием того или другого ее механизма. [4]
Кинетические закономерности реакции ( III-1), протекающей через предварительное образование комплекса YH - - - ZR за счет водородной связи, не столь разнообразны, поскольку равновесие образования таких комплексов устанавливается всегда быстро. [5]
Кинетические закономерности реакции (5.58) в условиях [ Е ] 0 [ S ] 0 наиболее просты. При соизмеримых концентрациях фермента и субстрата кинетику реакции описывает нелинейная система уравнений, решение которой сопряжено с математическими трудностями. [7]
Кинетические закономерности реакций трактуются также с точки зрения выполнения условий однородности поверхности и отсутствия взаимного влияния, но с учетом изменения числа активных мест катализатора. [8]
Кинетические закономерности реакций в реальных адсорбированных слоях могут быть истолкованы также с точки зрения изменений стационарного состояния и состава катализатора в ходе процесса. [9]
 |
Скорости окисления этилбензола в присутствии АИБН, СиО и NiO. [10] |
Кинетические закономерности реакции были изучены путем варьирования концентрации этилбензола, кислорода и количества катализатора. [11]
Кинетические закономерности реакции СО Н2О j CO2 Н2, установленные в присутствии исследуемых контактов, содержащих железо или его окислы, вполне согласуются с характером протекания реакции на железо-окисных катализаторах. [12]
Кинетические закономерности реакции замены диазогруппы на хлор в присутствии хлористой меди приводят, однако, к другому механизму этой реакции. Установлено, что скорость реакции прямо пропорциональна концентрации иона диазония ArN. [13]
Кинетические закономерности реакции замены диазогруппы на хлор в присутствии хлористой меди приводят, однако, к другому механизму этой реакции. Установлено, что скорость реакции прямо пропорциональна концентрации иона диазония ArN и комплексного аниона CuCl:; , образующегося присоединением хлор-иона к молекуле CuCl. С увеличением концентрации хлор-иона скорость реакции уменьшается прямо пропорционально квадрату его концентрации. Это указывает на то, что ион CuClj - ( образующийся присоединением двух ионов хлора к аниону CuCij) каталитически не активен. Поэтому целесообразно добавлять диазоний постепенно. [14]
Кинетические закономерности реакции изомеризации пропиленоксида на фосфате лития в газовой фазе носят сложный характер, но в указанном выше диапазоне условий скорость ее приблизительно описывается уравнением первого порядка по пропиленоксиду и катализатору. При более глубоком превращении становятся существенными и другие концентрационные факторы. [15]
Страницы: 1 2 3 4