Электрохимическая закономерность
Cтраница 1
Электрохимические закономерности составляют физико-химическую основу для расчетов процессов электрохимических производств. В технологии электрохимических производств широко пользуются законами Фарадея, Джоуля и Ома, Гесса и Кирхгофа, а также приближенной формулой для определения электродвижущей силы процесса. [1]
В сильно разбавленных растворах обна-дпения обычных электрохимических закономерностей, : т видно из дальнейшего, связаны с неоднородностью по-и могут служить для ее изучения. При больших раз-димо для этого применение радиоактивных индикаторов. [2]
Расплавленные электролиты в основном подчиняются тем же электрохимическим закономерностям, что и водные растворы, хотя электролизу расплавов присущи и некоторые специфические особенности. [3]
В связи с открытием все новых и новых сфер проявления электрохимических закономерностей представляется целесообразным и современным несколько видоизменить определение электрохимии как науки, изучающей взаимное превращение химической и электрической энергии. [4]
 |
Схема капиллярного электрометра.| Электрокапиллярная кривая. [5] |
Гун, а позднее - Фрумкина и его школы [12], позволили установить важнейшие электрохимические закономерности. [6]
Таким образом, теория электролитической диссоциации, выдвинутая Аррениусом, объяснила ряд опытных фактов, позволила выяснить многие новые электрохимические закономерности и вскоре получила широкое распространение. Взгляды, очень близкие к теории Аррениуса, высказал в 1881 г. Н. Н. Каяндер, впервые указавший на диссоциацию как на процесс, объясняющий химические особенности растворов электролитов. [7]
Так, при температуре ниже 250 С реакции в системе железо - вода протекают преимущественно в соответствии с электрохимическими закономерностями. При более высоких температурах железо контактирует не с водой, а с водяным паром, поведение которого описывается законами газообразной среды. [8]
Классические исследования, проведенные в этих системах в работах Липпмана, Гун, а позднее - Фрумкина и его школы [13], позволили установить важнейшие электрохимические закономерности. [9]
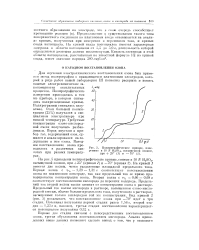 |
Полярографические кривые, измеренные п 10 N HsSO4, насыщенной озоном, при 25 ( 7 и - 70 ( 2. [10] |
Для изучения электрохимического восстановления озона был применен метод полярографии с вращающимся платиновым электродом, который в ряде работ нашей лаборатории [2] позволил раскрыть п понять важные электрохимические закономерности окислительных, процессов. [11]
Выяснение механизма сложного процесса в значительной мере заключается в установлении лимитирующей стадии, и если даже электровосстановление идет через адсорбированный водород, лимитирующая стадия может быть чисто электрохимической и тогда суммарный процесс будет подчиняться не химическим, а электрохимическим закономерностям. [12]
Выяснение механизма сложного процесса в значительной мере заключается в установлении лимитирующей стадии, и если даже электровосстановление идет через адсорбированный водород, лимитирующая стадия может быть чисто электрохимической, и тогда суммарный процесс будет подчиняться не химическим, а электрохимическим закономерностям. [13]
Магнитометрия не ограничивается биологией. Как известно, в основе большого числа фундаментальных биологических процессов лежат электрохимические закономерности. [14]
Как первый, так и второй тип межкристаллитной коррозии связан с окислительно-восстановительными свойствами коррозионной среды. Поэтому для объяснения причин возникновения межкристаллитной коррозии именно в данном определенном состоянии и ее механизма удобнее всего использовать приведенные ранее электрохимические закономерности, полученные методом потенциостатической поляризации. [15]
Страницы: 1 2