Газовые законы
Cтраница 1
Газовые законы были открыты опытным путем при исследовании поведения реальных газов в определенных условиях. В дальнейшем с развитием молекулярно-кинетической теории газа законы и уравнения состояния идеальных газов стало возможным выводить теоретическим путем. [1]
Газовые законы, рассмотренные в разд. [2]
 |
Изохоры идеального газа. [3] |
Газовые законы установлены экспериментально и довольно хорошо выполняются для реальных газов в определенных интервалах изменения параметров. [4]
Газовые законы химические 44 ел. [5]
Газовые законы связывают параметры данной массы газа попарно. В произвольных процессах изменяются все параметры, связанные друг с другом уравнением состояния. [6]
Газовые законы были открыты опытным путем при исследовании поведения реальных газов в определенных условиях. В дальнейшем с развитием молекулярно-кинетической теории газа законы и уравнения состояния идеальных газов стало возможным выводить теоретическим путем. [7]
Изложенные газовые законы в полной мере справедливы лишь для идеального газа. Поведение же реальных газов несколько отклоняется от этих законов, причем отклонения тем больше, чем выше давление газов и ниже их температура. [8]
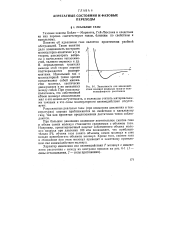 |
Зависимость сил взаимодействия молекул реальных газов от межмолекулярного расстояния. [9] |
Газовые законы Бойля - Мариотта, Гей-Люссака и следствия из них хорошо соответствуют газам, близким по свойствам к идеальному. [10]
Эмпирические газовые законы, которые объединяются уравнением состояния, справедливы для идеальных газов. Для реальных газов в уравнение состояния необходимо ввести поправки, учитывающие объем и силы взаимодействия молекул. [11]
Газовые законы Бойля-Мариотта, Гей-Люссака, Шарля и др., справедливые при использовании в качестве рабочих веществ идеальных газов, стали называться законами идеальных газов. [12]
Используемые газовые законы строго справедливы лишь для так называемых идеальных газов, в то время как мы применяем их для реальных газов. Это, несомненно, вводит некоторую погрешность во все замеры количества газа, но обычно можно этим пренебречь. [13]
Применяя газовые законы к разбавленным растворам, мы можем заменить Р и р концентрациями раствора Сие, так как осмотическое давление изменяется в зависимости от концентрации раствора. [14]
Какие газовые законы вам известны. Какие функциональные связи они вскрывают. [15]
Страницы: 1 2 3 4