Понижение - коэффициент - распределение
Cтраница 1
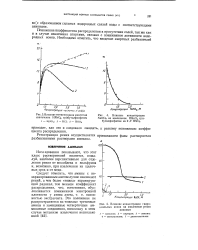 |
Влияние концентрации гидро. [1] |
Понижение коэффициента распределения в присутствии солей так же как и в случае извлечения спиртами, связано с понижением активности водородных ионов. [2]
Причиной понижения коэффициента распределения плутония и осколков деления в присутствии урана является то, что последний уменьшает количество свободного трибутилфосфата в органическом растворителе. [3]
В данном случае понижение коэффициента распределения с уменьшением равновесных концентраций зависит преимущественно от изменения состава экстрагируемых фенолов, а не от характера применяемого растворителя. Влияние температуры ясно из сопоставления коэффициента распределения для одной и той же ступени экстрагирования. [4]
При постоянной концентрации азотной кислоты наблюдается понижение коэффициента распределения с увеличением концентрации уранила. [5]
Тогда, согласно (11.98), присутствие комплексообразователя в водной фазе приводит к понижению коэффициента распределения при жатионообменной экстракции. Так как анионы минеральных кислот также являются комплексообразователями, то на практике коэффициент распределения зависит от природы аниона и понижается, например, при замене перхлората на нитрат или другие анионы. Введение посторонних солей ( высаливателей) при катионообменной экстракции нежелательно как вследствие увеличения функции F, так и из-за возможности изменения механизма экстракции на сольватный. [6]
Ряд исследований [34, 39, 44, 48] был направлен на установление количественной связи между повышением кислотности и понижением коэффициента распределения при постоянной концентрации лиганда. Уравнение ( 39) после замены а величиной й ( Н) рассчитанной согласно уравнению ( 55), можно приложить к описанию поглощения La ( III), Eu ( III) и Yb ( III) из слабокислых растворов нитрата лития. Если понижение D приписать в основном ассоциации комплексных кислот в растворе, то каждый член в знаменателе ( 38), отвечающий частице, способной к такой ассоциации, надлежит умножить на [ 1 2 - п ( / пнТн) ] - выражение, учитывающее ассоциацию комплексного аниона с п ионами водорода. [7]
Ряд исследований [34, 39, 44, 48] был направлен На установление количественной связи между повышением кислотности и понижением коэффициента распределения при постоянной концентрации лиганда. Уравнение ( 39) после замены а величиной ( Н), рассчитанной согласно уравнению ( 55), можно приложить к описанию поглощения La ( III), Eu ( III) и Yb ( III) из слабокислых растворов нитрата лития. Если понижение D приписать в основном ассоциации комплексных кислот в растворе, то каждый член в знаменателе ( 38), отвечающий частице, способной к такой ассоциации, надлежит умножить на [ 1 S - ( mH7H) nl - выражение, учитывающее ассоциацию комплексного аниона с п ионами водорода. Поскольку для учета ассоциации с лигандом применяется соотношение а - А. [8]
Добавление 2 9 М раствора NaC104 к 0 1 М раствору NaCl сопровождается понижением коэффициента распределения Hg ( II) в 4 - Ю4 раз. Аналогичные изменения наблюдаются в бромидной, нитратной и сульфатной системах. Перхлоратный эффект до настоящего времени не имеет приемлемого объяснения. [9]
Наиболее легко экстрагируемыми [ - излучающими продуктами деления являются цирконий и ниобий, и понижение коэффициента распределения Т - активности при понижении кислотности, вероятно, обусловливается гидролизом циркония до менее экстрагируемой формы. [10]
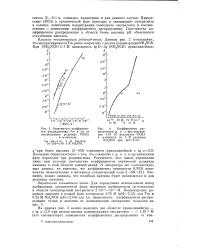 |
Зависимость коэффициентов распределения Тт и Lu от концентрации роданида ТКМА., в ж-ксилоле. [11] |
Присутствие HNCS в органической фазе приводит к связыванию экстрагента в сольват, понижению концентрации свободного экстрагента и соответственно - понижению коэффициентов распределения. Постоянство коэффициентов распределения в области более высоких рН объясняется отсутствием кислоты. [12]
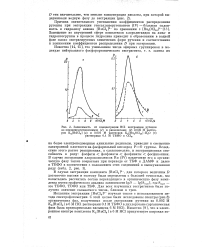 |
Зависимость от концентрации НС1 экстракции рутения из свежеприготовленных ( 1 и равновесных ( 2 М растворов K2 [ RuCle ] ( а и М растворов K4 [ Ru2OCl10 ] - H20 ( б растворами М ТБФО в СС14. [13] |
Замещение во внутренней сфере комплексов хлоролигандов на аква - и гидроксогрушш в процессе гидролиза приводит к образованию в водной фазе плохо экстрагируемых химических форм рутения и соответственно к понижению коэффициентов распределения D при экстракции. [14]
Но если увеличение прочности связи металла и ТБФ в экстрагируемом сольвате способствует переходу вещества в органическую фазу, то конкурирующий процесс - гидратация - действует в прямо противоположном направлении, удерживая РЗ в водной фазе. Естественно, что при низкой концентрации нитрат-ионов в растворе, когда доминирует процесс гидратации, понижение коэффициентов распределения будет сильнее у более тяжелых элементов. [15]
Страницы: 1 2