Понижение - коэффициент - распределение
Cтраница 2
В заключение укажем, что экстракция хелатов может быть использована как метод изучения комплексообразования ионов металла в водных растворах. Если в [ растворе образуется какой-либо недиссоциируемый комплекс Меи с лигандом В ( МеВт), то это обстоятельство сказывается в понижении коэффициента распределения данного элемента. [16]
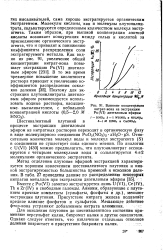 |
Влияние концентрации нитрат-иона на экстракцию Pu ( VI диэтиловым эфиром. [17] |
Молекулы кислоты, как и молекулы плутонилни-трата, сбльватируются определенным количеством молекул экстр-агента. Таким образом, при высокой концентрации азотной кислоты возникает конкуренция между солью и кислотой за присоединение органического экстр-агента, что и приводит к понижению коэффициента распределения соли экстрагируемого металла. [18]
Sb, Ga и Fe практически полностью остаются в водной фазе. Очевидно, определенную роль в предупреждении потерь Sb, Ga и Fe с золотом в этом случае играет то обстоятельство, что золото извлекается не полностью ( после трехкратной экстракции остается около 1 мг элемента), а это приводит к понижению коэффициентов распределения микропримесей в соответствии со сказанным ранее о подавлении их экстракции макроосновой. [19]
Коэффициенты распределения Pu ( IV) и Pu ( Vl) значительно увеличиваются, если часть азотной кислоты в водной фазе заменить нитратом натрия или другими азотнокислыми солями, нерастворимыми в ТБФ. Это позволяет устранить взаимодействие НМОз-с ТБФ. Чрезмерное уменьшение кислотности может привести к понижению коэффициента распределения Pu ( IV) вследствие его гидролиза. [20]
Зависимость коэффициента распределения от степени насыщения ионита металлом также исследована недостаточно широко и систематично. Проблемы, возникающие при высоком и при полном насыщении, рассмотрены выше. Что касается промежуточной области, то в ней следует ожидать понижения коэффициента распределения с возрастанием концентрации металла. [21]
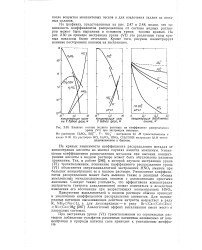 |
Влияние состава водного раствора на коэффициент распределения. [22] |
На кривых зависимости коэффициента распределения металла от концентрации кислоты во многих случаях имеется максимум. Уменьшение коэффициентов распределения металлов при высоких концентрациях кислоты в водном растворе может быть обусловлено разными причинами. Так, в работе [286], в которой изучали экстракцию урана ( VI) триоктиламином, понижение коэффициента распределения урана ( VI) объясняется сверхэквивалентной экстракцией HNOs амином при больших концентрациях ее в водном растворе. Уменьшение коэффициентов распределения может быть вызвано также и реакцией обмена комплексных металлсодержащих анионов с одноименными простыми анионами. [23]
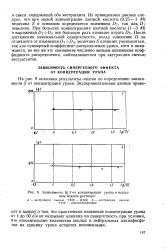 |
Зависимость Ig S от концентрации урана в исходном водном растворе. [24] |
Из приведенных данных следует, что при малой концентрации азотной кислоты ( 0 25 - 1 М) величина S в основном определяется значением DT, так как DT невелико. А все большую роль начинает играть D. После достижения максимальной синергетности, когда изменение D не отличается от изменения DJ DA, величина S начинает уменьшаться, так как суммарный коэффициент распределения урана, хотя и понижается, но все же это понижение численно меньше понижения коэффициента распределения, наблюдающегося при экстракции смесью экстрагентов. [25]
В табл. 41.1 показано влияние концентрации метанола и хлорида натрия на коэффициенты распределения ЛАС и АС на смоле в Н - форме. При использовании амберлита в Na - форме коэффициенты распределения ЛАС и АС гораздо ниже значений, приведенных в табл. 41.1. Это связано, вероятно, с тем, что в катионите действуют электростатические силы отталкивания между растворенным веществом и карбоксильными группами ионита, что и вызывает понижение коэффициентов распределения ЛАС и АС. Наоборот, при хроматографии на смоле в Н - форме вандерваальсово взаимодействие между растворенным веществом и смолой велико и коэффициенты распределения имеют высокие значения. [26]
Понижение D, наблюдаемое при Q 10 - 3 М, вызвано димеризацией Mo ( VI) в водной фазе. Последнее уменьшение аналогично понижению для 4 М НС1 и ДДЭ, диэтилового эфира и 2-этилгексанола. Это понижение не устраняется добавлением к системе HNO3 и, таким образом, вызвано димеризацией в водной фазе. Напротив, в результате добавления к системе HNO первое уменьшение IgD устраняется. Это показывает, что указанное уменьшение вызвано влиянием общего иона. Причина незначительности указанного эффекта для 4 М НС1 состоит в том, что с увеличением концентрации кислоты быстро возрастает количество НС1, экстрагированной кетоном. Следовательно, кривая для б М НС1 является горизонтальной в области Q от 10 - 9 до 10 - 4 М, после чего наблюдается незначительное понижение. В самом деле, при 7 М концентрации НС1 значение D более высокое, однако при большей концентрации НС1 увеличивающееся количество ионов водорода, переносимое в кетон экстрагированной НС1, настолько сильно подавляет экстракцию аниона, содержащего молибден, что его D уменьшается и становится не зависимым от Q в изученном диапазоне концентраций. Это заключение подтверждается также измерениями электропроводности. Метилизобутилкетон, находящийся в равновесии с 8 М НС1, имеет довольно высокую электропроводность, которая не увеличивается значительно, когда, помимо этого, водный раствор становится 10 - 2 М по молибдену. Однако добавление HNO3 или НС1О4 увеличивает электропроводность и вызывает понижение коэффициента распределения молибдена. [27]
Страницы: 1 2