Понятие - активность
Cтраница 2
 |
Зависимость логарифма среднего ионного коэффициента активности у от логарифма концентрации С электролита при 25 С для водных растворов. [16] |
Возможность применения понятия активности в кинетике химических реакций обосновывается теорией активированного комплекса Эйринга. Согласно этой теории, скорость реакции определяется скоростью распада активированного комплекса, а исходные вещества и продукты реакции находятся в равновесии с активированным комплексом, причем продукты реакции не влияют на равновесие, предшествующее замедленной стадии. [17]
С введением понятия активности трактовка символа рН должна быть изменена, так как она не учитывает разницы между истинной и активной концентрацией. [18]
Смысл введения понятий активности и коэффициента активности в том, что через них мы получаем возможность отображать свойства реальных растворов через свойства идеального раствора, вычислять численные значения свойств реальных растворов. [19]
Основное назначение понятий активности и коэффициента активности [75] состоит в облегчении термодинамического изучения растворов при отсутствии теоретических данных о зависимости свободной энергии от состава. Тем не менее, вероятно, будет полезно показать здесь, какую форму принимают выражения для этих величин в некоторых распространенных теориях растворов. [20]
Согласно определению понятия активности, алгебраическое произведение активностей различных компонентов при равновесии должно быть постоянным при постоянной температуре. [21]
Вначале будет введено понятие активности элемента, которое применимо как к обычной модели функционального элемента, так и к инерционному автомату. [22]
Общность и полезность понятия активности будут видны иа дальнейшего изложения. [23]
Поясним физический смысл понятия активности. Пусть компонент находится в растворе определенной концентрации и в газовой фазе над ним. [24]
Следует подчеркнуть, что понятие активности ионов или молекул не условное представление; оно отражает реальное количество частиц в единице объема системы, принимающих участие в большинстве физико-химических процессов. [25]
Таким образом, введение понятия активности позволяет свести учет неидеальности газов к вычислению некоторой величины / Су, зависящей от стехиометрии реакции и коэффициентов активности реагентов. Использование приведенных параметров, вытекающее из принципа соответственных состояний, позволяет применять один и тот же график или одинаковые табличные данные для расчета коэффициентов активности любых газов и паров. [26]
Собственно, только для растворов понятие активности и представляет интерес. При этом целесообразность применения этого понятия существенно зависит от продуманного, удачного выбора стандартных состояний шкалы активностей для растворителей и для растворенных веществ. На первый взгляд это может показаться странным, но оказывается ( как уже упоминалось вскользь на стр. [27]
Мы не характеризуем здесь ближе понятие активности, как оно фигурирует в физиологии активности Н. А. Вернштейна и в сходной концепции П. К. Анохина, отсылая читателя к статье: Ф. В. Бассин, Е. С. Геллер, В. Н. Свиндицкий, 1970 ( см. также совместную с Е. С. Геллером книгу автора, 1973, гл. [28]
После того как было уточнено понятие активности для растворов электролитов, рассмотрим, как можно найти эту величину, используя теорию сильных электролитов. [29]
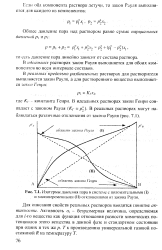 |
Изотермы давления пара в системе е положительными (. и знакопеременными ( II отклонениями от закона Рауля. [30] |
Страницы: 1 2 3 4