Понятие - активность
Cтраница 3
Для описания свойств реальных растворов вводится понятие активности. [31]
При рассмотрении каталитического действия часто пользуются понятием активности катализаторов. Точная формулировка этого по-нятия нелегка. [32]
В теорию сильных электролитов вместо концентрации вводят понятие активности ионов. Под активностью иона подразумевают ту кажущуюся концентрацию его, которая действует в химических реакциях, поэтому активность, так же как и концентрацию, выражают в молях, или грамм-ионах на 1 л раствора. [33]
В современной теории растворов вместо понятия концентрации используют понятие активности, Ks равно произведению активностей. Можно показать, что ионная сила растворов в анализе определяется не концентрацией ионов самого осадка, а главным образом концентрацией осадителя, который добавляют всегда в избытке, и концентрацией посторонних ионов, присутствующих в растворе. Поэтому использование произведения активностей в условиях качественного анализа встречает затруднения, так как в подавляющем большинстве случаев из-за сложности исследуемых растворов мы не можем вычислить ионную силу раствора и, следовательно, определить коэффициенты активности ионов. Вследствие этого мы в основном будем пользоваться не произведением активностей, а произведением концентраций, называя его Кв - В подавляющем большинстве случаев вносимая ошибка будет не существенна для качественных выводов. В тех случаях, когда ионная сила раствора может быть рассчитана, рекомендуется использовать произведение активностей. [34]
Чтобы отразить специфику электролитов в растворе, пользуются понятием активности ионов. Активность выражается в тех же единицах, что и концентрация: аус, где Y - коэффициент активности, с - концентрация. [35]
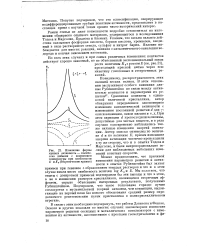 |
Изменение формы кривых активность - количество добавки с изменением температуры при симбатности Е и Ка ( теоретические кривые. [36] |
Попутно подчеркнем, что эта классификация, оперирующая недифференцированным грубым понятием активности, представляет в настоящее время с научной точки зрения чисто исторический интерес. [37]
Для жидкого или твердого состояния часто вместо фугитивности используют понятие активности. [38]
 |
Элемент Даниэля. [39] |
В электрохимии взаимодействие между ионами формально учитывают при помощи понятия активности ионов. В частности, в формулу Нернста вводят поправочный коэффициент, а именно вместо концентрации с пишут / с. Множитель / называется коэффициентом активности ионов, а произведение / с - активностью ионов в данном растворе. Значение / само зависит от концентрации и должно быть определено из дополнительных данных. [40]
Понятие отравления почти так же широко и неопределенно, как и понятие активности. Каждый раз, когда захват готовым катализатором постороннего вещества ухудшает его каталитические свойства, принято говорить об отравлении. Но это ухудшение может быть связано с различными изменениями твердого тела, оно может проистекать от различных кинетических эффектов. Поэтому проблема распознавания адекватного механизма дезактивации катализатора так же сложна, как и проблема установления адекватного механизма каталитического действия. [41]
Формальная модель строится относительно легко и в этом случае путем введения понятия активности компонента. Можно представить себе модель, в которой коэффициент активности учитывает все взаимодействия, а затем изменение какого-либо свойства рассчитывается по законам идеальных систем. Например, давление пара летучего компонента над бинарным растре ром может быть найдено следующим образом: Р Р а Р х, и, хотя это уравнение позволяет описать зависимость давления от состава достаточно точно, к пониманию природы раствора такой путь не приблизит нас ни на шаг. [42]
Для характеристики скорости ( интенсивности) распада атомов данного радиоактивного вещества вводится понятие активности, которое определяется числом ядер вещества, распадающихся в единицу времени. Так как со временем число атомов данного радиоактивного вещества уменьшается, следовательно, уменьшается и активность. [43]
Расчет равновесия в системах, не отвечающих закону Рауля, возможен благодаря понятию активности. [44]
Для характеристики поведения реальных систем Льюисом в 19U5 - 1908 гг. было введено понятие активности. Эта величина введена вместо концентрации с таким расчетом, чтобы ее использование дало возможность применить к реальным растворам законы идеальных систем. Таким образом, Льюис предложил изменить не функциональную зависимость между параметрами, определяющими состояние системы, а сам аргумент, оставляя вид зависимости таким же, что и для идеальной системы. [45]
Страницы: 1 2 3 4