Потенциал - ионизация
Cтраница 2
Потенциалы ионизации относятся к случаю отщепления электрона в условиях разреженного газа или в парах данного вещества, поэтому они не учитывают возможную гидратацию ионов, которая наблюдается при реакциях ионов в водных растворах. [16]
Потенциал ионизации равен разности потенциалов электрического поля, которую должен пройти электрон для приобретения нужной для ионизации атомов энергии. [17]
Потенциалы ионизации показывают увеличение основности с увеличением степени замещения, что также находится в соответствии с более эффективной индуктивной стабилизацией большими алкильными группами. [18]
Потенциал ионизации 1Р характеризует способность нейтрального атома терять часть своих электронов. Он измеряется энергией, необходимой для отрыва электрона от атома или иона, и количественно характеризует прочность связи данного электрона с атомом. Особенно характерны первые потенциалы ионизации, отвечающие отщеплению первого электрона от нейтрального атома. Чем меньше потенциал ионизации, тем легче атом теряет электрон. Потенциал ионизации химических элементов находится в периодической зависимости от заряда ядра атома. [19]
Потенциал ионизации - энергия, необходимая для отрыва от атома одного электрона. [20]
Потенциал ионизации обычно выражается в электрон-вольтах ( эВ); 1 эВ 1 6 - 10 - 12 эрг 3 83 - Ю-20 кал; 1 эВ - энергия, которую получает электрон, проходя через поле с разностью потенциалов в 1 В. [21]
Потенциалы ионизации, соответствующие двух - и трехкратно ионизованным атомам, естественно, большие величины, так как на отрыв электрона от положительно заряженного иона требуется больше энергии, чем на отрыв от нейтрального атома. [22]
Потенциал ионизации или наименьшая разность потенциалов на длине свободного пробега, при которой электрон приобретает скорость, достаточную для начала ударной ионизации, составляет: для паров металлов 6 - 7 5 В, для водорода 16 В, для гелия 24 В. [23]
Потенциал ионизации этой пары невелик ( 13 эв), что способствует образованию относительно прочной координационной связи. [24]
Потенциал ионизации относится к отрыву одного электрона. [25]
Потенциалы ионизации у атомов лантаноидов изменяются постепенно, несмотря на скачкообразные изменения радиуса атома. [26]
Потенциал ионизации является величиной, характерной для каждой занятой электронами молекулярной орбитали. [27]
Потенциалы ионизации некоторых фторированных метаноз приведены в табл. 6 вместе с данными для соответствующих водородных аналогов. Можно видеть, что потенциал ионизации возрастает с падением атомной массы галогена-заместителя. Неточность в определении значений для дихло - РИДО. В несколько высока, но, очевидно, что эту разницу можно уменьшить. Однако замещение одного атома фтора в производных метана, по-видимому, оказывает лишь незначительное влияние. [28]
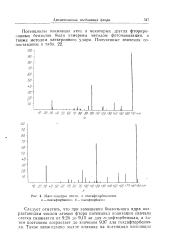 |
Масс-спекхры пента - и гексафторбензолов. а - пентафторбенэол. 6 - гексафторбензол. [29] |
Потенциалы ионизации этих и некоторых других фторированных бензолов были измерены методом фотоионизации, а также методом электронного удара. [30]
Страницы: 1 2 3 4 5