Потенциал - ионизация - металл
Cтраница 1
Потенциал ионизации металла, усредненный по его валентности в данном окисле. [1]
Сравнение потенциалов ионизации металлов и электронного сродства металлоидов показывает, что почти всегда энергия ионизации еф несколько превышает электронное сродство. Таким образом, переход электрона от атома Na к атому С1 не может происходить самопроизвольно и требует затраты некоторой энергии. [2]
Сравнение потенциалов ионизации металлов и электронного сродства металлоидов показывает, что почти всегда энергия ионизации eq несколько превышает электронное сродство. Таким образом, переход электрона от атома Na к атому С1 не может происходить самопроизвольно и требует затраты некоторой энергии. [3]
Сравнение потенциалов ионизации металлов и электронного сродства металлоидов показывает, что почти всегда величина р энергии ионизации несколько превышает электронное сродство. Для случая NaCl превышение составляет 1 3 да. Таким образом, переход электрона от атома Na к атому С1 не может происходить самопроизвольно и требует затраты некоторого количества энергии. С другой стороны, известно, что при образовании молекул выделяется энергия. Чтобы понять, откуда берется энергия, недостающая для ионизации атома щелочного металла, следует учесть, что при сближении ионов выделяется электростатическая энергия их взаимодействия. Образование ионов и их сближение представляет собой единый процесс, происходящий одновременно и лишь после того, как атомы сблизятся настолько, что вместе с образованием ионов выделяется необходимое для этого количество энергии. [4]
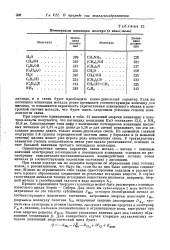 |
Потенциалы ионизации молекул ( в ккал / моль. [5] |
Если же потенциал ионизации металла резко превышает соответствующую величину для лиганда, то повышается вероятность перетягивания электронного облака к электронной системе металла, что будет иметь следствием усиление степени кова-лентности связи. [6]
 |
Потенциалы ионизации молекул ( в ккал / моль. [7] |
Если же потенциал ионизации металла резко превышает соответствующую величину для лиганда, то повышается вероятность перетягипания электронного облака к электронной системе металла, что будет иметь следствием усиление степени кова-лентности связи. [8]
Электроотрицательности и потенциалы ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям. [9]
При увеличении потенциалов ионизации металлов, имеющих внешние s - электроны, до 7 - 11 эв, ионный характер связи, который юнимается здесь как показатель степени асимметрии распределения электронной плотности в решетке, уменьшается и гидриды соответ -: твующих элементов приобретают черты сходства по характеру связи: гидридами переходных металлов и ковалентными гидридами. Эти идриды образуют группу промежуточных гидридов. [10]
В той же последовательности понижаются потенциалы ионизации металлов, входящих в состав этих соединений. [11]
Следовательно, энергия решетки может быть рассчитана по потенциалу ионизации металла, работе сродства галоида к электрону, теплоте сублимации металла, энергии диссоциации галоида и теплоте образования твердой соли. [12]
Де Бур установил связь между стабильностью азидов и потенциалом ионизации металла. Однако очень мало исследовался вопрос о том, каким путем можно использовать данные по ионизационным потенциалам, сродству ионов к электронам и ориентации ионов азида по отношению друг к другу для определения легкости разложения и чувствительности азидов. [13]
Потенциалы ионизации газов, как правило, значительно выше потенциалов ионизации металлов и сильнее различаются между собой, в результате чего влияние изменения состава анализируемого образца обычно значительно сильнее сказывается на условиях возбуждения отдельных компонентов газовой смеси, чем в случае обычных анализов. [14]
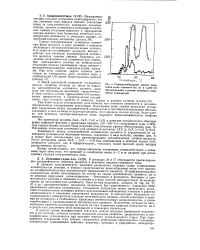 |
Термодесорбционные кривые выделения воды с цеолитов HY ( 1 и LaHY ( Я при нагревании в режиме линейного повышения температуры. [15] |
Страницы: 1 2 3