Потенциал - ионизация - молекула
Cтраница 2
Расчет потенциалов ионизации молекул в рамках теоремы Купменса в большинстве случаев правильно отражает порядок следования уровней ( для простых молекул) и величины потенциалов ионизации. В настоящее время накоплен, однако, материал, показывающий, что в ряде случаев необходим учет энергии релаксации и корреляции. Учет этих поправок ведет к установлению правильного порядка следования уровней и улучшает численное соответствие экспериментальных и теоретических данных. [16]
Из потенциала ионизации молекулы воды, равного 12 7 эв, для теплового эффекта процесса Н ОН Н9О получается величина 6 1 эв, следовательно, энергия отрыва протона от иона НзО должна быть больше 6 1 эв; аналогично для энергии процесса Н Н2О Н3О получается величина, большая 5 2 эв. Заметим, что, согласно измерениям В. Л. Тальрозе и Е. Л. Франкевича [257], энергия отрыва протона от иона НзО ( средство молекулы воды к протону) равна 7 33 0 15 эв. [17]
Как определяются потенциалы ионизации молекул. Почему при фотоионизации точность определения потенциалов ионизации наивысшая. [18]
Так как потенциалы ионизации молекул колеблются в нешироких пределах вблизи 10 эВ, то различие в энергии дисперсионного взаимодействия определяется главным образом поляризуемостью молекул. [19]
Так как потенциалы ионизации молекул BRi, способных образовывать водородные связи, изменяются в узком интервале ( А / в t l - f - 2 эв), то практически величина е, а следовательно, и смещение частоты Av должны зависеть от / в приблизительно линейно. На рис. 2 для ряда кислот RAH изображена зависимость AV / VO [ 5151 от / в [42] некоторых ароматических соединений. [20]
Для определения потенциалов ионизации молекул 02, С12 и 12 использован масс-спектрометр, в котором ионизацию вызывали моноэяергетические электроны. Там, где это оказалось возможным, результаты были сравнены со спектроскопическими данными, что позволило получить дополнительные сведения об электронной структуре исследованных молекул. [21]
Информация о потенциале ионизации молекул включена в табл. 19.4. В этом случае минимальная энергия отвечает переходу между нулевыми колебательными уровнями основных электронных состояний молекулы и молекулярного иона и может быть названа адиабатическим потенциалом ионизации молекулы. Основными методами экспериментального определения потенциалов ионизации молекул служат методы электронного удара, фотоионизации и спектроскопического определения предела ридберговских серий в полосатых спектрах молекул. Представленные в табл. 19.4 данные основаны на материале монографий [7,8] и многочисленных журнальных публикациях последнего десятилетия. [22]
Энергия диссоциации и потенциал ионизации молекулы BiO равны 339 6 кДж / моль и 9 0 0 5 эВ [317] Казенас и др. [318] показали, что Bi203 испаряется, в основном, с диссоциацией на газообразные висмут и кислород, что отличает этот окисел от аналогичных в данной группе периодической системы. Однако, авторы [318] неправильно установили молекулярный состав пара окислов сурьмы и висмута. [23]
Если emax больше потенциала ионизации молекул, то возникают ударная ионизация молекул и высокочастотный пробой газа, так как возникающие при ионизации электроны ускоряются полем до потенциала выше потенциала ионизации - возникает лавина. [24]
При спектроскопическом определении потенциалов ионизации молекул потенциал ионизации находится по пределу серии Ридберга в полосатых спектрах. В том случае, когда надежно установлено, что этот предел соответствует переходу между нулевыми колебательными уровнями основных электронных состояний иона и молекулы, определенный таким образом потенциал ионизации может быть назван адиабатическим. [25]
Наибольшее количество измерений потенциалов ионизации молекул выполнено с помощью метода электронного удара при использовании масс-спектрометра для идентификации и регистрации ионов. В этом методе основной экспериментальной процедурой при определении потенциалов ионизации является регистрация ионного тока в зависимости от ускоряющего электроны напряжения. При этом получаются так называемые кривые появления ионов, по которым и определяются потенциалы ионизации. [26]
Для этого значение потенциала ионизации молекул второго компонента должно быть ниже энергии возбуждения ( чаще всего наинизшего уровня) молекул первого. Известны случаи передачи энергии возбуждения с более высоких уровней. [27]
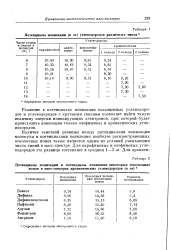 |
Потенциалы ионизации ( в углеводородов различных типов. [28] |
Наличие заметной разницы между потенциалами ионизации молекулы и потенциалами появления наиболее распространенных осколочных ионов также является одним из условий уменьшения числа линий в масс-спектре. Для парафиновых и олефиновых углеводородов эта разница составляет в среднем 1 - 2 эв. [29]
А и / в - потенциалы ионизации молекул А и В си и а в - поля ризуемости молекул. В общем случае энергия дисперсионного взаимодействия зависит от взаимной ориентации молекул. [30]
Страницы: 1 2 3 4 5