Потенциал - ионизация - молекула
Cтраница 3
Обычно наблюдалось, что если потенциал ионизации молекулы, содержащей гетероатом, значительно ниже, чем потенциал ионизации соответствующего незамещенного углеводорода, то ионизация происходит в результате выбивания электрона из неподеленной пары электронов функциональной группы. Влияние этой ионизации на дальнейшие пути фрагментации зависит от способности гетероатома стабилизовать положительный заряд. В настоящей главе будет показано, что для галогеноалкилов невозможна подобная корреляция между потенциалами ионизации и электроотрицательностью. [31]
 |
Взаимосвязь между потенциалами ионизации / ( зв некоторых - алканов СпН2п 2 и углеводородов других гомологических рядов. [32] |
На рис. 159 показано сравнение потенциалов ионизации молекул в различных гомологических рядах, органических соединений. [33]
Потенциал ионизации определен путем экстраполяции потенциалов ионизации молекул конденсированных ароматических соединений. [34]
Эти измерения, дающие для потенциала ионизации молекулы красителя величину 6 - 8 эв, доказывают правильность предположений Мотта и Митчелла. Легкость фотоионизации молекулы красителя, наблюдаемая как фотопроводимость компактных слоев красителей при освещении видимым светом, - иное явление. [35]
Потенциал ионизации определен путем экстраполяции потенциалов ионизации молекул галогенов. [36]
Теорема Купманса устанавливает соотношение между потенциалом ионизации молекулы и энергией занятой МО, а также между электронным сродством и энергией свободной МО. [37]
В табл. 8 и 9 приведены потенциалы ионизации молекул и радикалов органических и неорганических соединений. [38]
 |
Азотсодержащие молекулы и радикалы ]. [39] |
В табл. 22.2 - 22.6 приведены потенциалы ионизации молекул и радикалов. Имеющиеся во многих случаях различия между значениями потенциалов ионизации, определенными спектроскопически и методом электронного удара, следует объяснить тем, что в первом случае потенциалы ионизации адиабатические, а во втором - вертикальные. [40]
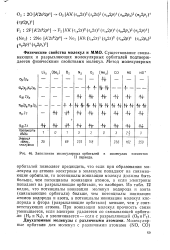 |
Заполнение молекулярных орбиталей в молекулах элементов. [41] |
Из табл. 12 видно, что потенциалы ионизации молекул водорода и азота ( связывающие орбитали) больше, чем потенциалы ионизации атомов водорода и азота, а потенциалы ионизации молекул кислорода и фтора ( разрыхляющие орбитали) меньше, чем у соответствующих атомов. [42]
В табл. 1 приведены данные по потенциалам ионизации молекул углеводородов различных типов. Аналогично для гептена-1 и децена-1 эти величины составляют 9 55 и 9 51 эв соответственно. [43]
При использовании метода электронного удара для определения потенциалов ионизации молекул существенным является вопрос о распределении используемых электронов по энергиям. Ионные источники, применяемые в аналитических масс-спектрометрах, дают распределение электронов по энергиям 1 5 - 2 эв на полувысоте. [44]
Существуют различные полутеоретические и полуэмпирические методы определения потенциалов ионизации молекул. Принципы метода расчета потентиалов ионизации были установлены Дж. Метод расчета основан на теории эквивалентных молекулярных орбит. [45]
Страницы: 1 2 3 4 5