Потенциал - ионизация - водород
Cтраница 1
Потенциал ионизации водорода в несколько раз больше, чем у щелочных металлов, и приблизительно равен потенциалу ионизации кислорода. Сродство к электрону составляет около одной пятой сродства к электрону галогенов. [1]
Потенциал ионизации водорода соизмерим с потенциалами ионизации галогенов. [2]
ЕЦ - потенциал ионизации водорода и Geft - эффективный фактор Гаунта, который находится полуэмпирически. [3]
А) и прочно удерживается - потенциал ионизации водорода 13 6 эв. Поэтому и по химическим свойствам он не похож на легко отдающие свой внешний электрон щелочные металлы. Кроме того, атому водорода достаточно присоединить еще один электрон, чтобы получить устойчивую оболочку Is2, такую же как у гелия, что делает его похожим на типичные металлоиды. [4]
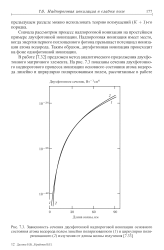 |
Зависимость сечения двухфотонной надпороговой ионизации основного состояния атома водорода полем линейно поляризованного ( 1 и циркулярно поляризованного ( 2 излучения от длины волны излучения. [5] |
Сначала рассмотрим процесс надпороговой на простейшем двухфотонной Надпороговая имеет место, энергия первого поглощенного фотона потенциал ионизации водорода. [6]
Из сравнения работы выхода электронов, находящейся в пределах 4 - 5 эВ, и потенциала ионизации водорода, равном 13 5 эВ, высказано предположение, что водород, растворяясь в металле, полностью не ионизируется и сохраняет электронную оболочку, представляющую собой сгущение валентных электронов металла, которое увлекается протоном при его движении в металл. [7]
ПИ ( В) - нижний адиабатический ПИ основания В, ПИ ( Н) - потенциал ионизации водорода. [8]
Здесь X - галоген, D - энергия диссоциации газообразной молекулы НХ, a Q - сумма потенциала ионизации водорода и электронного сродства галогена. Поскольку НС1, НВг и HI в растворе полностью диссоциированы, величина QpaCTB ( НХ) является измеряемой теплотой растворения газообразного НХ. [9]
Единственный электрон расположен очень близко от ядра ( расстояние между ними всего 0 5 А) и прочно удерживается - потенциал ионизации водорода 13 6 эв. Поэтому и по химическим свойствам он не похож на легко отдающие свой внешний электрон щелочные металлы. Кроме того, атому водорода достаточно присоединить еще один электрон, чтобы получить устойчивую оболочку Is2, такую же как у гелия, что делает его похожим на типичные металлоиды. [10]
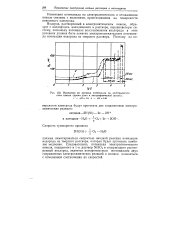 |
Изменение во времени потенциала на электролитическом никеле ( время даяо в логарифмической шкале. [11] |
Водород, растворенный в электролитическом никеле, образует с кислородом, находящимся в растворе, неравновесную си - - стему, поскольку потенциал восстановления кислорода в этих условиях должен быть заметно электроположительнее потенциала ионизации водорода из твердого раствора. [12]
Здесь пр, пе и п1 - соответственно числа протонов, электронов и атомов водорода в единице объема, Сн - вероятность рекомбинации атомов водорода на все уровни за одну секунду, &v - коэффициент поглощения атома водорода с первого уровня, рассчитанный на один атом, / zv0 - потенциал ионизации водорода, pv - плотность излучения, для вычисления которой следует взять формулу (1.1), с - скорость света. Левая часть (5.1) представляет собой число рекомбинаций в единице объема за одну секунду, а правая - число ионизации. [13]
Потенциалы ионизации разных порядков. В табл. 6 величина потенциала ионизации водорода принята за единицу; порядок потенциала ионизации указывается индексом. [14]
Зависимость между NH и Т, согласно уравнению (3.13), может быть разрешена, если привлечь данные по ИК - линиям кислорода. В области фотодиссоциации кислород находится в атомарном виде и нейтрален, поскольку его потенциал ионизации, 13 62 эВ, превосходит потенциал ионизации водорода. [15]
Страницы: 1 2